
【题目】某实验小组用下列装置制备溴苯,下列说法错误的是
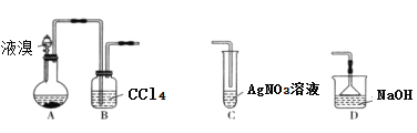
A. 装置A中长玻璃导管仅起冷凝回流作用,装置B中的实验现象是CCl4由无色变橙色
B. 若装置B后连接装置C,装置C中生成淡黄色沉淀,可证明装置A中发生取代反应
C. 若装置B后连接装置D,则装置D的作用是吸收尾气
D. 向反应后的装置A中加入NaOH溶液,振荡静置,下层为无色油状液体
【答案】A
【解析】
A. 苯和液溴在铁的作用下反应剧烈,可以达到沸腾,使苯和液溴挥发为蒸汽,在经过长导管时,可以将其冷凝并回流;产物中还有HBr气体,经过长导管最终被NaOH吸收,故长导管的作用是导气和冷凝回流。装置B中的CCl4吸收挥发出的溴和苯,CCl4由无色变橙色,A错误;
B. 苯和溴在催化剂条件下反应取代反应生成溴苯和HBr,若苯和溴发生加成反应,则没有HBr生成。装置B中已除去苯和溴的蒸汽,若装置C中产生淡黄色沉淀AgBr,则可证明气体中含有HBr,即可证明装置A中发生取代反应,B正确;
C. 装置B中除去苯和溴的蒸汽,可用NaOH溶液除去HBr气体,C正确;
D. 装置A中生成溴苯,溴苯中因为溶有溴而呈色,用NaOH溶液洗涤后,除去溴,溴苯为无色、密度比水大的油状液体,静置后在分液漏斗的下层,D正确;
故合理选项为A。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有 Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法正确的是
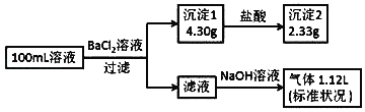
A. 若原溶液中不存在 Na+,则 c(Cl-)<0.1molL﹣1
B. 原溶液可能存在 Cl- 和 Na+
C. 原溶液中 c(CO32-)是 0.01molL﹣1
D. 原溶液一定存在 CO32-和SO42-,一定不存在 Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J是一种常用的抗组胺药物,一种合成路线如下:
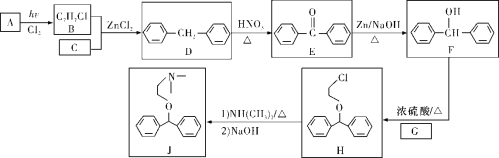
已知:①C为最简单的芳香烃,且A、C互为同系物。
②2ROH+NH3![]() HNR2+2H2O(R代表烃基)。
HNR2+2H2O(R代表烃基)。
请回答下列问题:
(1)A的化学名称是______________,H中的官能团名称是________________________。
(2)由D生成E的反应类型是__________,G的结构简式为________________________。
(3)B+C→D的化学方程式为______________。
(4)L是F的同分异构体,含有联苯结构,遇FeCl3溶液显紫色,则L有__________________(不考虑立体异构)种。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为______。
(5)写出用氯乙烷和2-氯-1-丙醇为原料制备化合物![]() 的合成路线(其他无机试剂任选) __。
的合成路线(其他无机试剂任选) __。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 在密闭容器中,使1molN2和3molH2充分反应后生成NH3的分子数为2NA
B. 标准状况下,0.56 L 丙烷中含有共价键的数目为0.2NA
C. 2g H218O和D2O 的混合物中,含有的中子数为NA
D. 若lmol 氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是
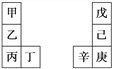
A. 金属性:甲>乙>丁
B. 乙的单质在空气中燃烧生成只含离子键的化合物
C. 原子半径:辛>己>戊
D. 丙与庚的原子核外电子数相差3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四元轴烯 t、苯乙烯 b 及立方烷 c 的分子式均为 C8H8。下列说法正确的是( )
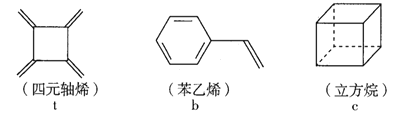
A. b 的同分异构体只有 t 和 c 两种
B. t 和b 能使酸性 KMnO4 溶液褪色而c不能
C. t、b、c 的二氯代物均只有三种
D. t、b、c 中只有 t 的所有原子可以处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2 与 Cl2 的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小 组通过图1 装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
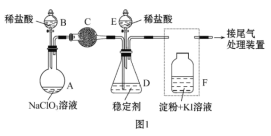
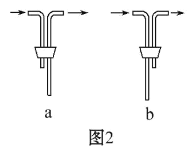
(1)仪器 D 的名称是___________。安装 F 中导管时,应选用图2中的___________。
(2)打开 B 的活塞,A 中发生反应:2NaClO3+4HCl![]() 2ClO2↑+Cl2↑+2NaCl+2H2O。为使 ClO2 在 D 中被稳定剂充 分吸收,滴加稀盐酸的速度宜___________ (填“快”或“慢”)。
2ClO2↑+Cl2↑+2NaCl+2H2O。为使 ClO2 在 D 中被稳定剂充 分吸收,滴加稀盐酸的速度宜___________ (填“快”或“慢”)。
(3)关闭 B 的活塞,ClO2 在 D 中被稳定剂完全吸收生成 NaClO2,此时 F 中溶液的颜色不变,则装置 C 的作用是___________ 。
(4)已知在酸性条件下 NaClO2 可发生反应生成 NaCl 并释放出 ClO2,该反应的离子方程式为___________,在 ClO2 释放实验中,打开 E 的活塞,D 中发生反应,则装置 F的作用是___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物能影响植物的生长,其氧化物也是大气的主要污染物之一。
(1)固氮直接影响作物生长。自然固氮发生的反应有:
①N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
②2NO(g)+O2(g)==2NO2(g) ΔH2=-114.1kJ·mo1-l
③N2(g)+2O2(g)=2NO2(g) ΔH3=__________kJ ·mol-l。
(2)一定温度下,将等物质的量的NO和CO通入固定容积为4L的密闭容器中发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),反应过程中CO的物质的量变化如图甲所示:
N2(g)+2CO2(g),反应过程中CO的物质的量变化如图甲所示:
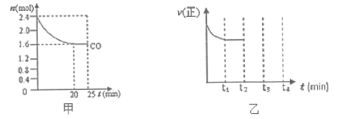
①能判断反应已达到化学平衡状态的是___________(填序号);
A.容器中的压强不变
B.2v正(CO)=v逆(N2)
C.气体的平均相对分子质量保持不变
D.NO和CO的体积比保持不变
②0~20min平均反应速率v(NO)为_______mol/(L·min);
③反应达平衡后再向容器中加入0.4molCO和0.4molCO2,则此时平衡______(填“向正反应方向移动”、“向逆反应方向移动”或“不移动”);
④该反应的正反应速率如图乙所示。在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在上图乙中,补充画出从t2到t4时刻正反应速率随时间的变化曲线。_____________;
(3)三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2,其反应分两步进行。第一步是:C3N3(OH)3![]() 3HCNO;第二步是HCNO与NO2反应,把氮元素和碳元素转变成无毒气体。请写出第二步发生的化学反应方程式_________________;
3HCNO;第二步是HCNO与NO2反应,把氮元素和碳元素转变成无毒气体。请写出第二步发生的化学反应方程式_________________;
(4)常温下,在x mol·L-1氨水中加入等体积的y mol·L-1硫酸得混合溶液M恰好显中性。
①M溶液中所有离子浓度由大到小的顺序为_________________。
②常温下,NH3·H2O的电离常数K=_______________(用含x和y的代数式表示,忽略溶液混合前后的体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型NaBH4/H2O2燃料电池DBFC的结构如图所示,该电池总反应方程式:NaBH4 +4H2O2= NaBO2+ 6H2O,有关的说法不正确的是
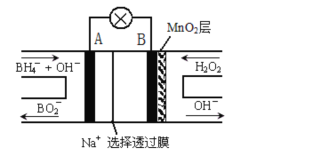
A. 电极B为正极
B. 放电过程中,Na+从正极区向负极区迁移
C. 电池负极的电极反应为:BH4-+8OH8e=BO2-+6H2O
D. 在电池反应中,每消耗1L6mol/LH2O2溶液,理论上流过电路中的电子为12NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com