
����Ŀ��Ŀǰ��ҵ�Ϻϳɰ��ķ�Ӧԭ��Ϊ:N2(g)+3H2(g) ![]() 2NH3(g) ��H=-92.4 KJ/mol
2NH3(g) ��H=-92.4 KJ/mol
��1���ں��º��������£���Ӧƽ����ϵ�г��뵪�����ﵽ��ƽ��ʱ��c(H2)��______(����������������С�������������������ж�������ͬ)��c(N2)��c(H2)��_______��
��2����ͼΪ�ϳɰ���Ӧ�ڲ�ͬ�¶Ⱥ�ѹǿ��ʹ����ͬ���������£���ʼʱ�����������������Ϊ1:3ʱ��ƽ�������а���������������ֱ���VA(NH3)��VB(NH3)��ʾ�ӷ�Ӧ��ʼ����ƽ��״̬A��Bʱ�Ļ�ѧ��Ӧ���ʣ���VA(NH3)_____VB(NH3)(����>����<������=")
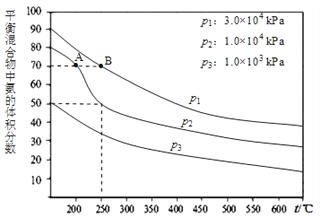
��3���������º�ѹ�£���һ�ݻ��ɱ�������У��ﵽƽ��״̬ʱ��N2��H2��NH3��1mol,����ʱ�ٳ���3molN2,��ƽ��____�ƶ�(������������������������)��
����������������1:1��Ϸ�Ӧʱ���ﵽƽ�����������¶ȵ��������������____(�����������С����������ͬ)���������ѹǿ���������������___��
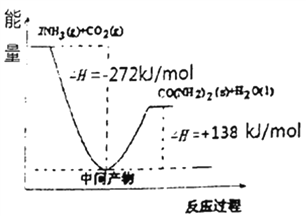
��4��H2NCOONH4�ǹ�ҵ�ϳ����ص��м����÷�Ӧ�������仯��ͼ��ʾ:��CO2�Ͱ��ϳ����ص��Ȼ�ѧ����ʽΪ________��
��5����ҵ�������ݳ��İ�����ϡ�������ա���ǡ������NH4HSO4������Һ�и����ӵ����ʵ���Ũ���ɴ�С��˳����__________��
���𰸡� ��С ���� < �� ����(����50%) ���� 2NH3��l��+CO2��g���TH2O��l��+H2NCONH2��H=-134KJ/mo1 c(H+)>c(SO42-)>c(NH4+)>c(OH-)
����������1���ں��º��������£�N2(g)+3H2(g) ![]() 2NH3(g)����Ӧƽ����ϵ�г��뵪��������Ӧ��Ũ�ȣ�ƽ�������ƶ����ﵽ��ƽ��ʱ��c(H2)����С����ƽ�ⳣ��k=c2(NH3)/c(N2)��c3(H2)��c(N2)��c(H2)=c2(NH3)/kc2(H2)���¶Ȳ��䣬k���䣬c2(NH3)����c2(H2)��С����c(N2)��c(H2)��������2���¶�Խ��ѹǿԽ��Ӧ����Խ����ͼ��֪��B��Ӧ���¶ȡ�ѹǿ����Ӧ���ʴ���VA(NH3) < VB(NH3)����3���ٺ��º�ѹ�£���һ�ݻ��ɱ�������У�N2��g��+3H2��g��
2NH3(g)����Ӧƽ����ϵ�г��뵪��������Ӧ��Ũ�ȣ�ƽ�������ƶ����ﵽ��ƽ��ʱ��c(H2)����С����ƽ�ⳣ��k=c2(NH3)/c(N2)��c3(H2)��c(N2)��c(H2)=c2(NH3)/kc2(H2)���¶Ȳ��䣬k���䣬c2(NH3)����c2(H2)��С����c(N2)��c(H2)��������2���¶�Խ��ѹǿԽ��Ӧ����Խ����ͼ��֪��B��Ӧ���¶ȡ�ѹǿ����Ӧ���ʴ���VA(NH3) < VB(NH3)����3���ٺ��º�ѹ�£���һ�ݻ��ɱ�������У�N2��g��+3H2��g��![]() 2NH3��g���ﵽƽ��״̬ʱ��N2��H2��NH3��1mol����ƽ��ʱ�������Ϊ1L�����¶���ƽ�ⳣ��K=12/1��13=1������ʱ�ٳ���3molN2�����º�ѹ�����֮�ȵ����������ʵ���֮�ȣ����������=1L��6/3=2L��Qc=
2NH3��g���ﵽƽ��״̬ʱ��N2��H2��NH3��1mol����ƽ��ʱ�������Ϊ1L�����¶���ƽ�ⳣ��K=12/1��13=1������ʱ�ٳ���3molN2�����º�ѹ�����֮�ȵ����������ʵ���֮�ȣ����������=1L��6/3=2L��Qc=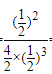 =1=k,��ƽ�ⲻ�ƶ�������������������1:1��Ϸ�Ӧʱ���ﵽƽ�������仯x����ƽ�����Ϊ1-x������Ϊ1-3x������Ϊ2x,�������������Ϊ(1-x)/(1-x+1-3x+2x)=0.5,���µ�����������������䣬Ϊ��ֵ50%���������ѹǿ�����������������������4����֪��2NH3��l��+CO2��g���TH2NCOONH4����������泥���l����H1=-272.0kJ��mol��1����H2NCOONH4��l���TH2O��l��+H2NCONH2��l����H2=+138.0kJ��mol��1�����ݸ�˹���ɣ���+�ڿɵã�2NH3��l��+CO2��g���TH2O��l��+H2NCONH2 ��l������H=-272.0kJ��mol��1+138.0kJ��mol��1=-134.0kJ��mol��1����5����ҵ�������ݳ��İ�����ϡ�������ա���ǡ������NH4HSO4������Һ�и����ӵ����ʵ���Ũ��c(H+)��Դ��NH4��ˮ���NH4HSO4���룬Ũ�����c(SO42-)ֻ��Դ��NH4HSO4���룬c(NH4+)Ҫˮ��һ���֣���c(SO42-)С���ɴ�С��˳����c(H+)>c(SO42-)>c(NH4+)>c(OH-)��
=1=k,��ƽ�ⲻ�ƶ�������������������1:1��Ϸ�Ӧʱ���ﵽƽ�������仯x����ƽ�����Ϊ1-x������Ϊ1-3x������Ϊ2x,�������������Ϊ(1-x)/(1-x+1-3x+2x)=0.5,���µ�����������������䣬Ϊ��ֵ50%���������ѹǿ�����������������������4����֪��2NH3��l��+CO2��g���TH2NCOONH4����������泥���l����H1=-272.0kJ��mol��1����H2NCOONH4��l���TH2O��l��+H2NCONH2��l����H2=+138.0kJ��mol��1�����ݸ�˹���ɣ���+�ڿɵã�2NH3��l��+CO2��g���TH2O��l��+H2NCONH2 ��l������H=-272.0kJ��mol��1+138.0kJ��mol��1=-134.0kJ��mol��1����5����ҵ�������ݳ��İ�����ϡ�������ա���ǡ������NH4HSO4������Һ�и����ӵ����ʵ���Ũ��c(H+)��Դ��NH4��ˮ���NH4HSO4���룬Ũ�����c(SO42-)ֻ��Դ��NH4HSO4���룬c(NH4+)Ҫˮ��һ���֣���c(SO42-)С���ɴ�С��˳����c(H+)>c(SO42-)>c(NH4+)>c(OH-)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ȡpH=2������ʹ�����Һ��100mL,�����зֱ����������Zn������Ӧ����������Һ��pH�仯����ͼ��ʾ������˵������ȷ����
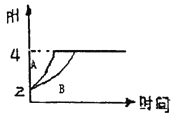
A. ͼ�б�ʾ������Һ��pH�仯���ߵ���B
B. ������ʹ����м����Zn�����ֱ�Ϊm1��m2,��m1<m2
C. pH=2ʱ����ʹ�������ʵ���ǰ��С
D. pH=4ʱ����Һc(Zn2+)���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ÿ��10��23������6:02������6:02����Ϊ��Ħ����"(Mole Day),���ʱ�����ʽд��Ϊ6:0210/23������밢���ӵ�����6.02��1023���ơ�NAΪ�����ӵ�������ֵ������˵����ȷ����
A. ��״����22.4 LNO��11.2LO2 ��ַ�Ӧ������ķ�����ΪNA
B. 0.1mol/L��Na2SO4��Һ����SO42- ��Ŀ��0.1NA
C. ��״����.22.4L�������������۳�ַ�Ӧ,ת�Ƶĵ�����Ϊ3NA
D. 0.1molCH4�ĺ��������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽд��ȷ����
A. ʯ��ʯ�ϵμ�ϡ����: CaCO3+2H+=Ca2++ H2O+CO2��
B. ���ˮ�еμ�FeCl3��Һ��Fe(OH)3����: Fe3++3H2O ![]() Fe(OH)3��+ 3H+
Fe(OH)3��+ 3H+
C. ����SO2ͨ��Ca(ClO)2��Һ��: SO2+ H2O + Ca2++ 2ClO-= CaSO3��+2HClO
D. ����ʯ��ˮ������С�մ���Һ���: Ca2++ OH-+ HCO3-=CaCO3��+ H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Լ��ı��淽�����������
A.��Ũ���������ɫƿ�У��������䰵������
B.��AgNO3������ɫƿ�б���
C.��NaOH��Һ���ڴ���Ƥ���IJ���ƿ��
D.���������ڲ���ƿ�У���Na������ú����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йز�����;��˵���в���ȷ����( )��
A.�������մɿ�������ѹ�ƵƵĵƹ�
B.�������մɿ������մɷ������IJ���
C.���ά������ң��ң�ء�������
D.�������մɿ������뵼�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڢ�MgO��CuO��CaO��SO2;��C��Fe��S��P;��ZnCl2��BaCO3��HNO3��NaNO3����������,ÿ�����һ�������ڷ������������������ʲ�ͬ,���������ʷֱ���(����)
A. CuO��Fe��ZnCl2 B. SO2��S��NaNO3
C. CaO��C��BaCO3 D. SO2��Fe��HNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���S2Cl2����һ�ֻƺ�ɫҺ�壬�д̼��ԡ���Ϣ�Զ�����۵�Ϊ��80�棬�е�137.1�森�ڿ�����ǿ�ҷ��̣�����ˮ������Ӧ������ʹ����������ʹ�����ı��������ȷ�ճ�����Ӳ�IJ������ܣ������ڵ�����ͨ��������������S2Cl2 �� ��ͼ��ʵ������S��Cl2�Ʊ�S2Cl2��װ�ã��г�װ�á�����װ�þ�����ȥ���� 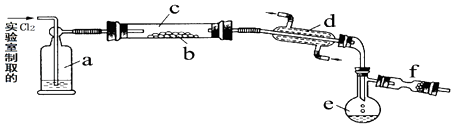
��1����֪S2Cl2���ӽṹ��H2O2���ƣ���д��S2Cl2�ĵ���ʽ ��
��2��װ��a��Ӧ���Լ�Ϊ �� ������Ϊ ��
��3����ʵ��IJ���˳��ӦΪ���ک�������ű�ʾ���� �ټ���װ��c ��ͨ��Cl2��ͨ����ˮ ��ֹͣͨCl2��ֹͣ����װ��c
��4��fװ����Ӧ���õ��Լ�Ϊ �� ������Ϊ ��
��5����֪S2Cl2��H2O��Ӧʱ��ֻ��һ��Ԫ�صĻ��ϼ۷����˱仯���ұ������ͱ���ԭ�ĸ�Ԫ�ص����ʵ���֮��Ϊ1��3����д���÷�Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ģ��ֲ��Ĺ�����ã�������������̫���⡢ˮ��������̼(CO2)�ϳɼ���(CH4)���˹����ϵͳ,�乤��ԭ����ͼ��ʾ������˵����������� ��
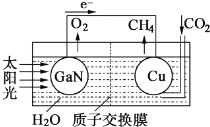
A. GaNΪ����,CuΪ���� B. ��װ����ֻ��������������ת��
C. GaN�缫�ĵ缫��ӦʽΪ2H2O-4e-=4H++O2�� D. ��װ�ù���ʱ,H+��Cu�缫�ƶ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com