
| A. | 硅胶可用作食品干燥剂 | |
| B. | 烧碱固体可用作食品干燥剂 | |
| C. | P2O5不可用作食品干燥剂 | |
| D. | 具有吸水性的植物纤维可用作食品干燥剂 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
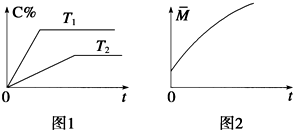 在密闭容器中投入一定量的A和B发生反应:
在密闭容器中投入一定量的A和B发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | 打开碳酸型饮料的瓶盖,有大量的气体从饮料中冒出 | |
| D. | 用高压锅蒸煮食物更省时间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质的水溶液导电性要比弱电解质的水溶液导电性强 | |
| B. | SO2水溶液的导电性很好,所以 SO2是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | 强电解质的水溶液中不存在溶质分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一分子O4由两分子O2构成 | |
| B. | O4是一种单质 | |
| C. | 等质量的O4和O2含有相同数目的分子 | |
| D. | O4是一种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液与氢氧化钠溶液混合:HCO3-+OH-═H2O+CO32- | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀 H2SO4反应:Ba2++SO42-=BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应容器内的压强不随时间改变 | |
| B. | 反应容器内P、Q、R、S四者共存 | |
| C. | P的生成速率和S的生成速率相等 | |
| D. | 反应容器内的气体总物质的量不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备1,2-二溴乙烷的反应原理如下:C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br,可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:
实验室制备1,2-二溴乙烷的反应原理如下:C2H5OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,CH2=CH2+Br2→CH2BrCH2Br,可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示.回答下列问题:| 本题中出现有机物相关数据 | |||
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com