
| 1.2g |
| 60g/mol |
| 1.44g |
| 18g/mol |
| 2.64g |
| 44g/mol |
| 0.32g |
| 16g/mol |
| 0.06mol |
| 0.02mol |
| 0.16mol |
| 0.02mol |
| 0.02mol |
| 0.02mol |


科目:高中化学 来源: 题型:
| A、Fe2O3俗称铁红,常用作红色油漆和涂料 |
| B、Na2SiO3俗称水玻璃,是制备硅胶和木材防火剂的原料 |
| C、CH3COOH俗称醋酸,是食醋的主要成分 |
| D、SiC俗称金刚砂,可用作砂纸、砂轮的磨料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 的分子式是
的分子式是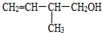 .该有机物中所含官能团的名称是
.该有机物中所含官能团的名称是查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 | 解释(用化学方程式表示) | |
| ① | 将充满NO2的倒立在盛有水的水槽中,拨去橡皮塞,轻轻晃动试管. | 试管内气体由 | |
| ② | |||
| ③ | 重复步骤②的操作数次,直至液体充满整个试管. | 试管内充满无色液体. | 总反应方程式: |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| 催化剂 |

| n(H2O) |
| n(CH4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
1 1 |
2 1 |
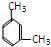 和
和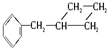
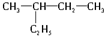 和
和 
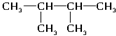 和
和 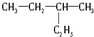
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com