
| A. | Al Al2O3 | B. | Al2O3NaAlO2 | C. | Fe Fe3O4 | D. | Fe Fe(OH)2 |
分析 A.铝与氧气反应可生成氧化铝;
B.氧化铝与氢氧化钠反应可生成NaAlO2;
C.铁在氧气中燃烧可生成Fe3O4;
D.铁与碱不反应,不能直接生成Fe(OH)2.
解答 解:A.铝为活泼金属,可与氧气反应可生成氧化铝,可通过一步反应完成,故A不选;
B.氧化铝为两性氧化物,与氢氧化钠反应可生成NaAlO2,可通过一步反应完成,故B不选;
C.铁在氧气中燃烧可生成Fe3O4,也可与水蒸气反应生成Fe3O4,可通过一步反应完成,故C不选;
D.铁与碱不反应,不能直接生成Fe(OH)2,可先与酸反应生成亚铁离子,再与碱反应生成Fe(OH)2,不能一步反应完成,故D选.
故选D.
点评 本题主要考查了铁、铝及其化合物的化学性质的应用,为高频考点,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,熟悉物质的性质是解答的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.8 | B. | 11.6 | C. | 23.2 | D. | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇完全燃烧生成二氧化碳和水 | |
| B. | 乙醇能与水任意比混溶 | |
| C. | 乙醇在铜催化下可被氧化 | |
| D. | 0.1mol乙醇与足量的钠反应只能生成0.1g氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H4和C2H6 | B. | C2H2和C6H6 | C. | C3H6O和C3H8O2 | D. | C3H8O和C4H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H18(l)+22.5O2(g)═8CO2(g)+9H2O(g);△H=-48.40kJ•mol-1 | |
| B. | C8H18(l)+22.5O2(g)═8CO2(g)+9H2O(l);△H=-5518kJ•mol-1 | |
| C. | C8H18(l)+22.5O2(g)═8CO2(g)+9H2O(l);△H=+5518kJ•mol-1 | |
| D. | C8H18(l)+22.5O2(g)═8CO2(g)+9H2O(l);△H=-48.40kJ•mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ④⑤⑥ | C. | ②⑤⑥ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ②⑤ | B. | ①②③⑧ | C. | ①②③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 和CH3CH2CH2Br的方法如图1.
和CH3CH2CH2Br的方法如图1.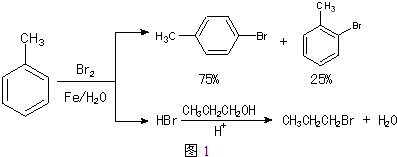
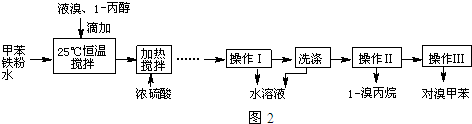
| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
| 沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |
 .
.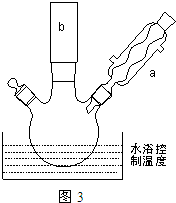 ①图中玻璃仪器a的名称是冷凝管,方块b中为某玻璃仪器,其名称是分液漏斗.
①图中玻璃仪器a的名称是冷凝管,方块b中为某玻璃仪器,其名称是分液漏斗.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com