
根据以下叙述制备氯化铜:将含有FeO杂质的CuO粉末慢慢加入浓盐酸中,充分
反应后粉末溶解。已知:FeS不溶于水,但溶于强酸。
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥9.6 | ≥6.4 |
在除去溶液中的Fe2+时,可采用的方法是
A.加入纯铜粉,将Fe2+还原为Fe
B.直接加NaOH溶液,调整溶液的pH≥9.6
C.先将Fe2+氧化成Fe3+,再调整溶液pH至3.7~4
D.通入H2S使Fe2+直接沉淀
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z在元素周期表中的位置如下图所示。下列说法正确的是

A. W的非金属性比Z的弱
B. W的最高价氧化物对应的水化物是强酸
C. Y的原子半径在同周期主族元素中最大
D. Z的气态氢化物的稳定性在同主族元素中最强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质间的转化不能通过一步反应完成的是( )
A.Fe2O3―→Fe(OH)3 B.CO2―→C
C.SiO2―→H2SiO3 D.Si―→Na2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关叙述不正确的是
A.铝热反应是炼铁最常用的方法
B.Na2O2用作呼吸面具的供氧剂
C.Na2FeO4有强氧化性,可用作自来水的消毒剂
D.小苏打和氢氧化铝均可用来作治疗胃酸过多的药物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分子或离子在指定的溶液中一定能大量存在的是
A.常温下呈中性的溶液:Fe3+ 、Na+、Cl-、SO42-
B.1 mol/L的NaAlO2溶液:NH3•H2O、CO32-、K+、SiO32-
C.与铝单质反应产生氢气的溶液: Na+、K+、NO3-、Mg2+
D.由水电离出的c(H+)=1×10-12mol/L溶液:HCO3-、NO3-、Na+、Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量CO2通入2L某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示。下列有关叙述
不正确的是
A.通入的CO2气体在标准状况下的体积约为22.4 L
B.原溶液中c(NaOH)=2mol/L
C.A溶液中含Na2CO3和NaHCO3 各1mol
D.A溶液中含有2molNaOH和1mol Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
某单质跟足量浓硝酸反应时(还原产物只有NO2)每有0.5 mol的单质反应就消耗2 mol HNO3,则单质中的元素氧化后的化合价可能是下列中的:①+1 ②+2  ③+3 ④+4( )
③+3 ④+4( )
A.② B.④
C.②④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
固态化合物A由两种短周期元素组成,可与水发生复分解反应。甲组同学用下图装置(夹持装置略)对其进行探究实验。
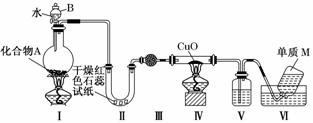
(1)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为________;Ⅳ中发生反应的化学方程式为_____________________________________;
Ⅴ中的试剂为________。
(2)乙组同学 进行同样实验,但装置连接顺序为Ⅰ-Ⅲ-Ⅳ-Ⅱ-Ⅴ-Ⅵ,此时Ⅱ中现象为________,原因是_______________________________________________________
进行同样实验,但装置连接顺序为Ⅰ-Ⅲ-Ⅳ-Ⅱ-Ⅴ-Ⅵ,此时Ⅱ中现象为________,原因是_______________________________________________________
________________________________________________________________________。
(3)经上述反应,2.5 g化合物A理论上可得0.56 L(标准状况)M,则A的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3化合物。请回答:
(1)X、Y、Z元素的名称分别是____________、________、________。
(2)化合物XZ3的分子式是__________________,电子式是____________。
(3)分别写出X、Y的含氧酸的分子式______________、____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com