
分析 (1)①氯化铁具有强氧化性,铜能被氯化铁氧化,所以电解质溶液为FeCl3溶液;
②Cu易失电子发生氧化反应而作负极;
③石墨作正极,则盐桥中阳离子向正极移动;
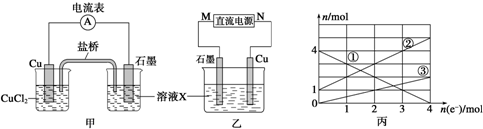
(2)根据丙图可知溶液中有三种金属阳离子,而根据X的成分可知X中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此Cu做阳极,石墨做阴极,根据转移电子的物质的量和金属阳离子的物质的量的变化确定曲线对应的离子,结合转移电子的物质的量计算;
(3)①电解时阳极失电子发生氧化反应.
②铁失电子和氢氧根离子生成高铁酸根离子和水.
③高铁酸根离子有强氧化性,被还原生成的三价铁离子能发生生成胶体,胶体具有吸附性.
解答 解:(1)①氯化铁具有强氧化性,铜能被氯化铁氧化,所以反应为2FeCl3+Cu=CuCl2+2FeCl2,则FeCl3溶液为电解质溶液,故答案为:FeCl3;
②Cu作负极,失电子发生氧化反应,电极反应为Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+;
③Cu作正极,放电时,电解质溶液中阳离子K+移向X溶液中,故答案为:K+;
(2)①根据丙图可知溶液中有三种金属阳离子,而根据X的成分可知X中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此Cu做阳极,石墨做阴极,所以M是负极,故答案为:负;
②根据转移电子的物质的量和金属阳离子的物质的量的变化,可知①为Fe3+,②为Fe2+,③为Cu2+,故答案为:Fe2+;
③当电子转移为2mol时,溶液中有Fe3+ 2mol,Fe2+ 3mol,Cu2+为1mol,所以溶解铜的质量为64g,故答案为:64g;
(3)①电解时阳极发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O,故答案为:Fe+8OH--6e-═FeO42-+4H2O;
②NaClO氧化Fe(OH)3的反应方程式为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,故答案为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O;
③高铁酸钠具有强氧化性,所以能杀菌消毒;高铁酸钠能被还原生成铁离子,铁离子能水解生成氢氧化铁胶体,胶体具有吸附性,能吸附悬浮杂质,所以能净水,
故选BC.
点评 本题考查了电解原理和原电池原理,为高考热点问题,难点是(2)题图象分析,知道溶液中离子浓度变化及其原因,题目难度中等.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:选择题
| A. | CH2O和CO2分子中的中心原子均采用sp2杂化 | |
| B. | CH3SH 的相对分子质量比CH3OH大,因此前者的沸点高 | |
| C. | C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子 | |
| D. | 甲胺(分子式CH3NH2)的沸点比三甲胺[分子式(CH3)3N]的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CHCl3是三角锥形 | |
| B. | 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 | |
| C. | AB2是V形,其A可能为sp2杂化 | |
| D. | NH4+是平面四边形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2~4 s内的平均反应速率为0.2 mol•L-1•s-1 | |
| B. | 前4 s内的平均反应速率为0.3 mol•L-1•s-1 | |
| C. | 前2 s内的平均反应速率为0.4 mol•L-1•s-1 | |
| D. | 2 s末的反应速率为0.4 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容器内压强 | B. | 平均相对分子质量 | ||
| C. | 各组分浓度 | D. | 混合气体的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com