
| A. | 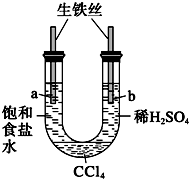 一段时间后,a管液面高于b管液面并且a处溶液的pH增大,b处溶液的pH 减小 | |
| B. |  继续煮沸溶液至红褐色,停止加热,当光束通过体系时无丁达尔效应 | |
| C. | 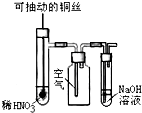 微热稀HNO3溶液片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 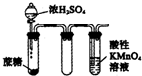 酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
分析 A.中性条件下,铁丝发生吸氧腐蚀,酸性条件下,铁丝发生析氢腐蚀;
B.胶体具有丁达尔效应;
C.Cu和稀硝酸反应生成NO和硝酸铜,NO不稳定,易被氧气氧化生成红棕色气体二氧化氮;
D.蔗糖与浓硫酸发生氧化还原反应生成二氧化碳、二氧化硫、水,二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化.
解答 解:A.中性条件下,铁丝发生吸氧腐蚀,酸性条件下,铁丝发生析氢腐蚀,所以a极发生吸氧腐蚀、b极发生析氢腐蚀,会导致右边溶液低于左边,a极生成氢氧根离子、b极生成氢气,所以a、b极附近溶液的pH都增大,故A错误;
B.胶体具有丁达尔效应,该实验能制得氢氧化铁胶体,能产生丁达尔效应,故B错误;
C.Cu和稀硝酸反应生成NO和硝酸铜,NO不稳定,易被氧气氧化生成红棕色气体二氧化氮,所以广口瓶内气体呈红棕色,故C错误;
D.蔗糖与浓硫酸发生氧化还原反应生成二氧化碳、二氧化硫、水,二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及金属腐蚀与防护、胶体性质、元素化合物性质等知识点,明确实验原理、物质性质是解本题关键,注意铁发生吸氧腐蚀和析氢腐蚀区别,题目难度不大.


科目:高中化学 来源: 题型:选择题
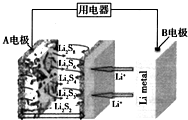
| A. | B电极为正极 | |
| B. | A电极上的电极反应式为:2Li++S8+2e-═Li2S8 | |
| C. | 每生成1molLi2S8转移0.25 mol电子 | |
| D. | 给该电池充电时,A电极连接电源的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
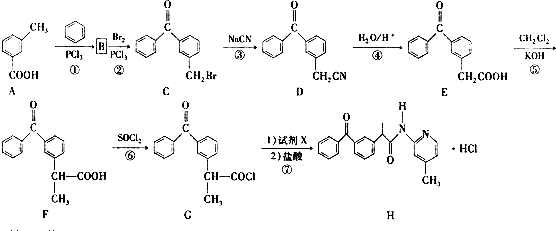
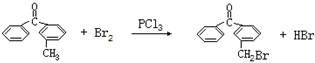 .
.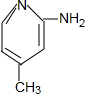 .
.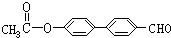 、
、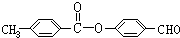
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 104 | 66 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW3 | |
| C. | Y的氧化物对应的水化物一种是强酸 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
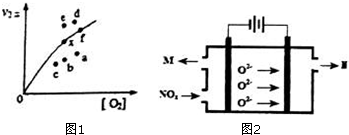 研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)?2NO2(g)的速率却随着温度的升高而减小.查阅资料知
研究氮氧化物的反应机理,对于消除对环境的污染有重要意义.升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)?2NO2(g)的速率却随着温度的升高而减小.查阅资料知查看答案和解析>>
科目:高中化学 来源: 题型:选择题
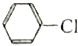 的水解反应均有醇生成.
的水解反应均有醇生成.| A. | 全都正确 | B. | 除⑤ | C. | 除⑥ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2分解的热化学方程式为H2O2(l)═H2O(l)+$\frac{1}{2}$O2(g)△H=-98 kJ•mol-1 | |
| B. | 反应速率与Fe2+浓度有关 | |
| C. | 在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | △H1+△H2=196 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
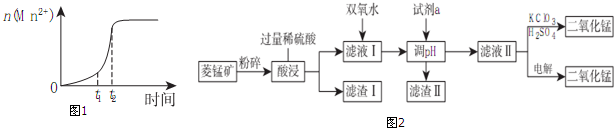
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时pH | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时pH | 10.0 | 8.4 | 3.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com