
【题目】下列说法或做法正确的是( )
A.金属离子只有氧化性,非金属离子只有还原性
B.硫酸亚铁溶液中需加入还原铁粉防止亚铁离子氧化
C.用50mL量筒量取2mL蒸馏水
D.金属钠保存在盛有煤油的细口瓶中
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N |
键能/(kJ/mol) | 351.5 | 463 | 393 | 293 |
则该反应的ΔH=________kJ/mol。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①下列说法不能判断该反应达到化学平衡状态的是________。
A.体系中气体的密度保持不变
B.CO的消耗速率与CH3OH的消耗速率相等
C.体系中CO的转化率和H2的转化率相等
D.体系中CH3OH的体积分数保持不变
②平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________。
③某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,同时生成I2,写出发生的化学反应方程式__________________。
(4)HI的制备:将0.8molI2(g)和1.2molH2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7/span> |
HI体积分数 | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
①该反应的平衡常数K=_____________。
②反应达到平衡后,在7min时将容器体积压缩为原来的一半,请在图中画出c(HI)随时间变化的曲线_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气CO和H2,还对温室气体的减排具有重要意义。
已知:C(s)+2H2(g)=CH4(g) △H1 K1 C(s)+O2(g) =CO2(g) △H2 K2 ;C(s)+![]() O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
O2(g) =CO(g) △H3 K3;CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H K(其中△H为焓变,K为平衡常数)下列说法正确的是
A. △H=2△H3-2△H2-△H1
B. K=2K3-K2-K1
C. 若平衡时c(CH4):c(CO2):c(CO):c(H2)=1:1:1:1,则K一定等于1(mol/L)2
D. 减小压强可增大CH4(g)和CO2(g)的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A. NH4Cl+NaOH=NaCl+NH3![]() +H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3
+H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3![]()
C. Cl2+2NaOH=NaClO+NaCl+H2O D. 2Na2O2+2H2O=NaOH+O2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过溶解、过滤、蒸发等操作,可将下列各组固体混合物分离的是( )
A. 硝酸钠和氢氧化钠 B. 二氧化锰和氧化铜
C. 氯化钾和二氧化锰 D. 碳酸钾和氯化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ(1)燃料电池是一种高效、环境友好的发电装置。氢氧燃料电池已用于航天飞机。以氢氧化钾溶液为电解质溶液的这种电池的负极反应式为_______________,这种电池在放电使用一段时间后,电解质溶液中的c(OHˉ)将___________(填“增大”“减小” 或“不变”)。
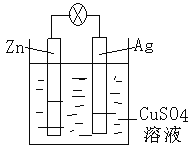
(2)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。回答下列问题:锌为_______极,该电极上发生_________反应(“氧化”或“还原”),电极反应式为__________,该原电池的总反应离子方程式为__________________________________。
Ⅱ.一定温度下将6mol的A及6molB混合于2L的密闭容器中,发生如下反:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
(1)平衡时D的浓度=________。
(2)B的平均反应速率v(B)=____________。
(3)x=________________。
(4)开始时容器中的压强与平衡时的压强之比为_______(化为最简整数比)。
(5)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2mol·L-1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应__________;每消耗3.4gNH3转移的电子数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】树立健康生活理念,正确认识和使用药物。下列说法错误的是( )
A.阿司匹林(aspirin)是一种解热镇痛药物
B.非处方药OTC安全系数大,可以长期大量服用
C.常用的抗酸药是氢氧化铝复方制剂
D.吃药期间不宜喝茶,更不宜用茶水服药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦
B. 制取并用排水法收集氧气结束后,应立即停止加热
C. 蒸发结晶操作时,为了得到纯净的晶体应将溶液蒸干
D. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①NaClO溶液;②Cu;③稀硫酸;④BaSO4;⑤乙醇;⑥SiO2;⑦乙烯;⑧熔融的KCl;⑨石墨;⑩冰醋酸。回答下列问题:
(1)上述物质中属于电解质的是______。(填写序号,以下同)
(2)上述物质中可以导电的是______。
(3)写出在催化剂存在条件下⑦转化为⑤的化学方程式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com