
【题目】下列各组物质,原子间的化学键类型不同的是
A.HCl、HNO3B.H2O、NH3C.MgCl2、NaFD.CCl4、KOH
科目:高中化学 来源: 题型:
【题目】已知 ![]() ,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按如图路线合成:
,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按如图路线合成: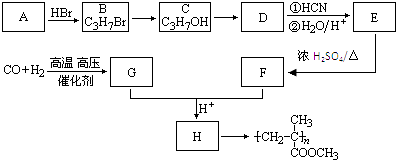
(1)A、E的结构简式分别为:、;
(2)B→C、E→F的反应类型分别为:、;
(3)写出下列转化的化学方程式:C→D;G+F→H;
(4)要检验B中的Br元素,可用的操作和现象为 .
(5)写出符合下列要求的H的同分异构体①有一个支链②能使溴的四氯化碳溶液褪色③跟NaHCO3反应生成CO2 , . (只要求写出2个)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠及其化合物具有广泛的用途.
(1)工业上制备金属钠的常用方法是 . 试写出制备金属钠的化学方程式 . 金属钠可用于 (写出Na在熔点低方面的一种用途).
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池.该电池的结构如图所示: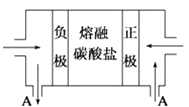
①正极的电极反应式为 , 电池工作时物质A可循环使用,A物质的化学式为 .
②请写出检验Na2CO3中钠元素的方法 .
(3)常温下,浓度均为0.1molL﹣1的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaCO | NaCN |
pH | 8.8 | 9.7 | .6 | 0.3 | . |
上述盐溶液的阴离子中,结合H+能力最强的是 , 根据表中数据,浓度均为0.01molL﹣1的下列四种酸的溶液分别稀释100倍,pH变化最大的是(填序号).
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯.
①常温下,当300mL 1molL﹣1的NaOH溶液吸收4.48L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为 .
②已知几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时,(填离子符号)先沉淀,Ksp[Fe(OH)2] Ksp[Mg(OH)2](填“>”、“=”或“<”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出.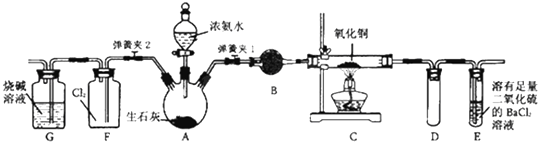
(1)在组装好装置后,若要检验A﹣E装置的气密性,其操作是先
和 , 然后微热A,察到E中有气泡冒出,移开酒精灯,E中导管有水柱形成说明装置气密性良好.
(2)请用平衡移动的原理解释A中制取氨气的原理 .
(3)装置B中盛放试剂是 .
(4)关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗活塞,点燃C处酒精灯,装置C中黑色固体逐渐变红,装置E中
(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式 .
(5)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量.若反应前固体质量为16g,反应后称重固体质量减少2.4g.通过计算确定该固体产物的成分是 .
(6)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中.写出产生白烟的化学方程式 . 迅速产生倒吸的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解苦卤水 (含C1﹣、Br﹣、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( ) 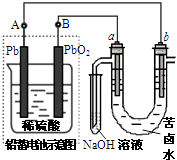
A.铅蓄电池负极的反应式为:Pb﹣2e ﹣→Pb2+
B.铅蓄电池放电时,该电池两极质量均减少
C.铅蓄电池充电时,B极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂硫电池是以硫元素作为电池正极,金属锂作为负极的一种锂电池.单位质量的单质硫放电比容量高达1675mAh/g,远远高于商业上广泛应用的钴酸锂电池的容量(<150mAh/g).并且硫是一种对环境友好的元素,对环境基本没有污染,锂硫电池是一种非常有前景的锂电池.其工作原理如图所示.下列关于锂硫电池的说法不正确的是( ) 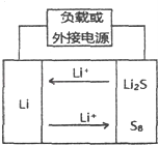
A.放电时,锂为负极,发生还原反应
B.充电时阳极反应式为:8Li2S﹣16e﹣═S8+16Li+
C.电解质可采用导电有机电解质
D.锂硫电池的理论电压为2.0V,则单位质量的单质硫的比能量为3.35 kWh/kg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:Li+2Li0.35NiO2![]() 2Li0.85NiO2,下列说法不正确的是( )
2Li0.85NiO2,下列说法不正确的是( )
A.放电时,负极的电极反应式:Li-e-===Li+
B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质溶液
D.放电过程中Li+向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列反应的熵值的变化,在每小题后面的横线上填上“增加”“减小”或“无明显变化”。
(1)2H2(g)+O2(g)![]() 2H2O(l) 。
2H2O(l) 。
(2)H2(g)+Cl2(g)![]() 2HCl(g) 。
2HCl(g) 。
(3)(NH4)2CO3(s)![]() NH4HCO3(s)+NH3(g) 。
NH4HCO3(s)+NH3(g) 。
(4)Cu(s)+Cl2(g)![]() CuCl2(s) 。
CuCl2(s) 。
(5)将少量KNO3晶体溶解在水中 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com