
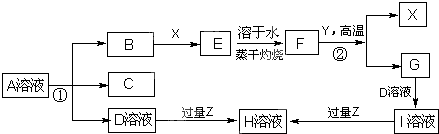
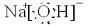
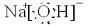
| ||
| 高温高压 |
| ||
| ||
| 高温高压 |
| ||


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:阅读理解
| 元素 | A | B | C | D |
| 结构性质 信息 |
基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 | 原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有2对成对的p电子 | 其原子序数比A、B、C三种元素原子的质子数总和还少1,有+1、+2两种常见化合价 |
| A-O | A=O | F-O | F=O | |
| 键能(KJ/mol) | 360 | 803 | 464 | 640 |
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.

查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||


查看答案和解析>>
科目:高中化学 来源:2012届山西省山大附中高三第一次模拟试题理综化学试卷(带解析) 题型:填空题
【化学-物质结构与性质】(15分)
原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素。回答下列问题:
(1)甲能形成多种常见单质,在熔点较低的单质中,每个分子周围紧邻的分子数为 ;在熔点很高的两种常见单质中,X的杂化方式分别为 、 。
(2)14g乙的单质分子中π键的个数为___________。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第
二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第 电离能。
(4)戊的基态原子有 种形状不同的原子轨道;
(5)丙和丁形成的一种离子化合物的晶胞结构如图,该晶体中阳离子的配位数为 。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=__________cm。 (用含ρ、NA的计算式表示)
(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒,推测这两种微粒的空间构型为
查看答案和解析>>
科目:高中化学 来源:2013-2014学年黑龙江省佳木斯市高三第三次调研化学试卷(解析版) 题型:填空题
A、B、C、D、E、F、G、H八种前四周期元素,原子序数依次增大,化合物甲由A、D、E三种元素组成,常温下0.1mol/L甲溶液的pH=13;B、F同主族,F是重要的半导体材料。G为前四周期单电子数最多的元素,H最外层电子数与G相同。
(1)G的元素符号是_________原子的价电子排布图为______________
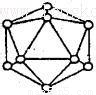
(2)短周期元素I与F性质相似,晶体类型相同,基本单元如图所示,可表示为I12,则其基本结构中含有正三角形的个数为____________
(3)C与其同族相邻元素J所形成的简单气态氢化物键角大小关系_______________(用 化学式表示)原因_____________________________
(4)B与D两元素组成的常见无机粒子中,其空间构型可能是 (填写序号)。
a.直线型 b.平面三角形 c.三角锥形 d.正四面体
(5)H原子晶体堆积模型为________________,若其密度为ρg/cm3 阿伏伽德罗常数为NA,求最近两个H原子间的距离为_________________pm(列出计算式)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省高三第一次模拟试题理综化学试卷(解析版) 题型:填空题
【化学-物质结构与性质】(15分)
原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素。回答下列问题:
(1)甲能形成多种常见单质,在熔点较低的单质中,每个分子周围紧邻的分子数为 ;在熔点很高的两种常见单质中,X的杂化方式分别为 、 。
(2)14g乙的单质分子中π键的个数为___________。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第
二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第 电离能。
(4)戊的基态原子有 种形状不同的原子轨道;
(5)丙和丁形成的一种离子化合物的晶胞结构如图,该晶体中阳离子的配位数为 。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a=__________cm。 (用含ρ、NA的计算式表示)

(6)甲、乙都能和丙形成原子个数比为1:3的常见微粒,推测这两种微粒的空间构型为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com