
 ,H2NCl中氯的化合价为+1价.
,H2NCl中氯的化合价为+1价. 分析 (1)根据分子的空间结构判断;
(2)根据分子中中心原子的价层电子对数判断;
(3)根据杂化理论分析氨气分子的空间构型,H2NCl分子结构类似于NH3,据此书写电子式,根据化合价的代数和为零计算.
解答 解:(1)CCl4为正四面体结构键角为109°28′,H2O分子的空间结构为V形,键角为为107°,BeCl2的空间结构为直线形,键角为180°,BCl3的空间结构为平面三角形,键角为120°,所以键角由大到小的顺序为BeCl2>BCl3>CCl4>H2O;
故答案为:BeCl2>BCl3>CCl4>H2O;
(2)硫化氢(H2S)中S元素的价层电子对数=2+$\frac{1}{2}$(6-2×1)=4,含有2孤电子对,所以分子的空间构型为 V形;二氧化碳(CO2)中C原子分子的价层电子对数=2+$\frac{1}{2}$(4-2×2)=2,不含有孤电子对,空间构型为 直线形;甲烷(CH4)分子中C原子分子的价层电子对数=4+$\frac{1}{2}$(4-4×1)=4,没有孤电子对,空间构型为正四面体;
故答案为:V形;直线形;正四面体;
(3)NH3分子中的氮原子sp3杂化,有一个杂化轨道容纳弧对电子对,所以构型为三角锥,H2NCl分子结构类似于NH3,所以H2NCl分子的空间构型为三角锥型,NH3属于共价化合物,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ,则H2NCl分子的电子式为
,则H2NCl分子的电子式为 ;H2NCl中H为+1价,N为-3价,则Cl为+1价;
;H2NCl中H为+1价,N为-3价,则Cl为+1价;
故答案为:三角锥形; ;+1价.
;+1价.
点评 本题考查了分子空间构型的判断、键角、电子式的书写等,题目难度中等,注意把握分子中原子的价层电子对数的判断方法.


科目:高中化学 来源: 题型:选择题
 中药厚朴皮中起抗菌作用的有效成分为厚朴酚,其结构简式如图所示.该物质具有持久的肌肉松弛作用和极强的抗菌作用,临床上主要用于镇静中枢神经、抗真菌等.
中药厚朴皮中起抗菌作用的有效成分为厚朴酚,其结构简式如图所示.该物质具有持久的肌肉松弛作用和极强的抗菌作用,临床上主要用于镇静中枢神经、抗真菌等.| A. | 1个厚朴酚分子中含有16个碳原子 | |
| B. | 厚朴酚能使酸性KMnO4溶液褪色,遇FeCl3溶液显色 | |
| C. | 1mol厚朴酚与足量NaHCO3溶液反应放出22.4LCO2(标准状况) | |
| D. | 1mol厚朴酚能与4molBr2(Br2的CCl4溶液)反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 塑料、人造纤维和合成橡胶都属于有机高分子化合物 | |
| B. | 食品透气袋里放入盛有硅胶和铁粉的小袋,可防止食物受潮、氧化变质 | |
| C. | Na2FeO4能与水缓慢反应生成Fe(OH)3和O2,可以作为饮用水的消毒剂和净化剂 | |
| D. | 草木灰和铵态氮肥不能混合使用,是因为NH4++HCO3-═CO2↑+H2O+NH3↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子方程式 | 评价 |
| A.亚磷酸是一种二元酸,在其中加入过量的烧碱溶液: H3PO3+3OH-=PO33-+3H2O | 正确 |
| B.在亚硫酸中加入少量的次氯酸钠溶液 H2SO3+ClO-=Cl-+2H++SO42- | 正确 |
| C.在碳酸氢镁溶液中加入过量氢氧化钠溶液: Mg2++2HCO3-+2OH-=Mg CO3↓+CO32-+2H2O | 错误:生成物应是 Mg(OH)2和Na2CO3 |
| D.在过氧化钠中加入稀硫酸: 2Na2O2+4H+=4Na++2H2O+O2↑ | 正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

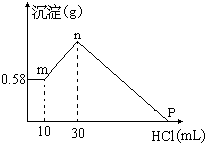
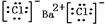 ,沉淀A的晶体类型离子晶体,CO32-的空间构型是平面三角形.
,沉淀A的晶体类型离子晶体,CO32-的空间构型是平面三角形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和H2SO4 | B. | Na2SO3和盐酸 | C. | Na2S和HCl | D. | Na2SO3和H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 反应开始20 s内以二氧化氮表示的平均反应速率为0.00125 mol/L•s | |
| B. | 80 s时向容器中加入0.32 mol氦气,同时将容器扩大为 4 L,则平衡将不移动 | |
| C. | 当反应达到平衡后,若缩小容器的体积,平衡向生成N2O4方向移动,气体的颜色变深 | |
| D. | 若其它条件不变,起始投料改为0.40 mol N2O4,相同条件下达平衡,则各组分含量与原平衡体系对应相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com