
| A. | 3.1g由白磷和红磷组成的混合物中含有磷原子的数目为0.1NA | |
| B. | 0.1mol丙烯醛中含有双键的数目为0.1NA | |
| C. | 标准状况下,2.24L乙醇中含有的分子数目为0.1NA | |
| D. | 1molNaHSO4固体中阳离子的数目为2NA |
分析 A、白磷和红磷均由磷原子构成;
B、丙烯醛中含一条碳碳双键和一条碳氧双键;
C、标况下乙醇为液态;
D、硫酸氢钠由钠离子和硫酸氢根构成.
解答 解:A、白磷和红磷均由磷原子构成,故3.1g混合物中含有的磷原子的物质的量为0.1mol,个数为0.1NA个,故A正确;
B、丙烯醛中含一条碳碳双键和一条碳氧双键,故0.1mol丙烯醛中含0.2NA条双键,故B错误;
C、标况下乙醇为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故C错误;
D、硫酸氢钠由钠离子和硫酸氢根构成,故1mol硫酸氢钠中含1mol阳离子即NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
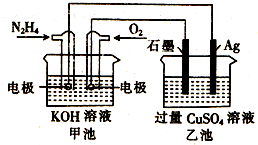
| A. | 该装置工作时,Ag电极上有气体生成 | |
| B. | 甲池中负极反应为N2H4-4e-=N2+4H+ | |
| C. | 甲池和乙池中的溶液的pH均减小 | |
| D. | 当甲池中消耗0.1mol N2H4时,乙池中理论上最多产生6.4g固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
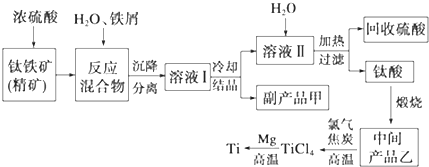
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
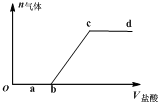 向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应溶液中:Ca2+、Mg2+、Br-、NO3- | |
| B. | b点对应溶液中:Al3+、Fe3+、MnO4-、NO3- | |
| C. | c点对应溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应溶液中:F-、NO3-、Fe2+、Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 甲中试剂 | 乙中试剂 | 气体成份及实验目的 | 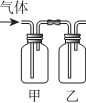 |
| A | NaHSO3溶液 | 硅酸钠溶液 | HCl:证明非金属Cl>S>Si | |
| B | FeI2淀粉溶液 | FeI2、KSCN溶液 | Cl2:验证氧化性Cl2>Fe3+>I2 | |
| C | 溴水 | AgNO3溶液 | 乙烯:验证溴水与乙烯发生的是加成反应 | |
| D | Ba(OH)2溶液 | 品红溶液 | 验证混合气体中含有SO2和CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(甲)>v(乙)>v(丙) | B. | v(乙)>v(丙)>v(甲) | C. | v(丙)>v(乙)>v(甲) | D. | v(乙)>v(甲)>v(丙) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融状态下硫酸氢钾的电离方程式:KHSO4═K++H++SO42- | |
| B. | Cl-的结构示意图: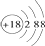 | |
| C. | 中子数为8的碳原子:${\;}_{6}^{14}$C | |
| D. | NaCl的电子式: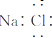 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com