
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量粗盐于试管中,往试管中滴加过量稀盐酸,并用带导管的胶塞迅速塞住试管,导管的另一端通入澄清石灰水,观察现象, | (1)若能观察到试管中有气泡产生,产生的气体能使澄清石灰水变浑浊,则说明假设1或假设3成立;(2)若无明显现象则说明______成立. |
| 步骤2:继续往试管中滴加______,观察现象. | (1)若能观察到______结合步骤1中的(1)则说明______成立; (2)若无明显现象,结合步骤1中(1)则说明______成立. |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量粗盐于试管中,往试管中滴加过量稀盐酸,并用带导管的胶塞迅速塞住试管,导管的另一端通入澄清石灰水,观察现象, | (1)若能观察到试管中有气泡产生,产生的气体能使澄清石灰水变浑浊,则说明假设1或假设3成立; (2)若无明显现象则说明 假设2 成立. |
| 步骤2:继续往试管中滴加 氯化钡溶液,观察现象. | (1)若能观察到 不溶于稀盐酸的白色沉淀生成,结合步骤1中的(1)则说明 假设3 成立; (2)若无明显现象,结合步骤1中(1)则说明 假设1 成立. |


科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
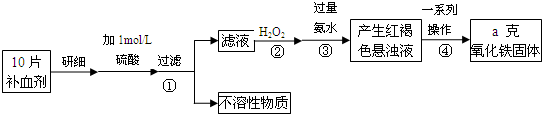
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
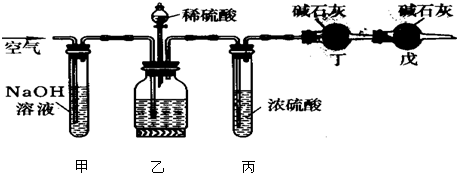
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuCl2、KCl | B.KCl、(NH4)2SO4 |
| C.CuCl2、NaOH | D.CuCl2、(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
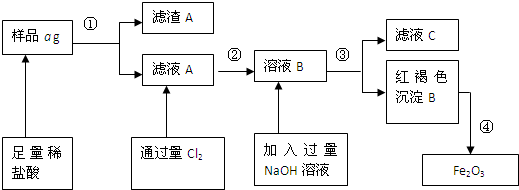
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
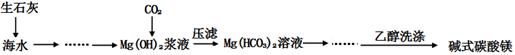
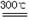 (x+y)MgO+xCO2↑+(y+z)H2O
(x+y)MgO+xCO2↑+(y+z)H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com