
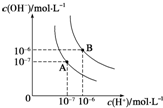
 (1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示95℃时水的电离达平衡时的离子浓度.则95℃时0.1mol?L-1的NaOH溶液中,由水电离出的 c(H+)=
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示95℃时水的电离达平衡时的离子浓度.则95℃时0.1mol?L-1的NaOH溶液中,由水电离出的 c(H+)=| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
| 电离出的离子浓度 |
| 原来总浓度 |
| 0.001mol |
| 0.1L |
| 电离出的离子浓度 |
| 原来总浓度 |
| 0.001 |
| 0.2 |


科目:高中化学 来源: 题型:
| A、13C与14C |
| B、CH3CH2OH与CH3COOH |
| C、甲烷与丙烷 |
D、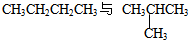 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
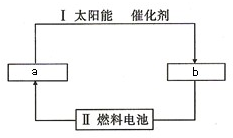 氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.
氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进入煤矿井时,用火把照明 |
| B、用点燃的火柴在液化气钢瓶口检验是否漏气 |
| C、节日期间,在开阔的广场燃放烟花炮竹 |
| D、实验时,将水倒入浓硫酸配制稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
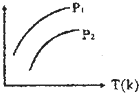 下图表示不同温度(T)和压缩(P)对可逆反应2L(g)?2M(g)+N(g);△H>0影响情况,已知P2>P1,则图中纵轴表示的意义可能是( )
下图表示不同温度(T)和压缩(P)对可逆反应2L(g)?2M(g)+N(g);△H>0影响情况,已知P2>P1,则图中纵轴表示的意义可能是( )| A、①② | B、①③ | C、②④ | D、③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com