
| A. | 碳酸氢钠能发生水解反应,可用作食品的膨松剂 | |
| B. | 四氯化碳密度比水大,可用于萃取溴水中的Br2 | |
| C. | O3能使蛋白质发生变性,可用于杀菌、消毒 | |
| D. | SO2具有漂白性,可用KMn04标准溶液滴定食品中S02残留量. |
分析 A.依据碳酸氢钠不稳定性,受热分解生成二氧化碳解答;
B.萃取剂和原溶剂不互溶,且萃取剂和溶质不反应,溶质在萃取剂中的溶解度大于在原溶剂中的溶解度;
C.臭氧具有强氧化性能够使蛋白质变性;
D.二氧化硫有毒,二氧化硫具有还原性能够还原酸性高锰酸钾.
解答 解:A.碳酸氢钠可用作食品的膨松剂是因为碳酸氢钠受热分解生成二氧化碳,与碳酸氢钠的水解无关,故A错误;
B.萃取剂和原溶剂不互溶,且萃取剂和溶质不反应,溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,四氯化碳符合萃取剂条件,与其密度大小无关,故B错误;
C.臭氧具有强氧化性能够使蛋白质变性,可以用来杀菌消毒,故C正确;
D.二氧化硫有毒,不能用于食品添加剂,用KMn04标准溶液滴定食品中S02残留量,体现二氧化硫的还原性,与漂白性无关,故D错误;
故选:C.
点评 本题考查了物质的性质与应用之间关系,明确物质的性质是解题关键,注意萃取剂选择原则为频考点,易错点,题目难度中等.


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源: 题型:填空题
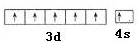 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | 肥皂 | C. | C17H35COONa | D. | 高级脂肪酸 |
查看答案和解析>>
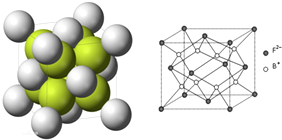
科目:高中化学 来源: 题型:选择题
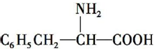 )相同,且同时符合下列条件:①有带两个取代基的苯环,②有一个硝基直接连接在苯环上,这种同分异构体的数目为( )
)相同,且同时符合下列条件:①有带两个取代基的苯环,②有一个硝基直接连接在苯环上,这种同分异构体的数目为( )| A. | 3种 | B. | 6种 | C. | 8种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | Y | |
| Z |
| A. | 非金属性:Z>Y | |
| B. | 原子的半径:W<X | |
| C. | Z的氧化物能与Y的氢化物反应生成强酸 | |
| D. | Z一种单质熔点为119℃,易溶于二硫化碳,则该单质属于原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
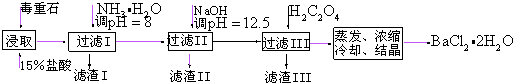
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com