
| A、在潮湿的空气中能形成白雾的气态氢化物,一定是氯化氢 | B、溶于水能形成无色溶液的红棕色气体,一定是二氧化氮 | C、某物质燃烧后的产物既能使白色硫酸铜粉末变蓝,又能使澄清的石灰水变浑浊,该物质一定是碳氢化合物 | D、灼烧某织物纤维,可闻到烧焦羽毛气味,说明该织物是棉织物 |


科目:高中化学 来源: 题型:
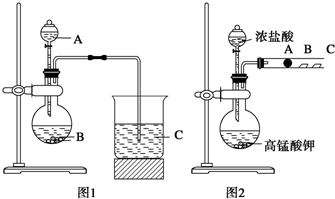 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
10(W2-W1)×
| ||
| a |
10(W2-W1)×
| ||
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下测得等物质的量浓度碳酸的pH大于盐酸的pH,所以碳元素比氯元素的非金属性弱 | B、向无色溶液通入Cl2 后,溶液变为黄色,加入淀粉溶液后溶液变蓝,说明原溶液中有I- | C、向溴苯中加入稀氢氧化钠并加热,冷却后取出少量溶液于小试管中,加入稀AgNO3溶液,未发现有浅黄色沉淀生成,由此确定溴苯还未水解 | D、向无色溶液加BaCl2溶液,生成白色沉淀,再加稀盐酸,沉淀不消失,由此确定该溶液中一定含有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com