
 在恒定温度T℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:
在恒定温度T℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:分析 (1)由图象可知,15min达到平衡,反应物A物质的量变化0.2mol,B变化物质的量0.1mol,C变化物质的量0.2mol,化学方程式的计量数之比等于ABC发生反应的物质的量之比;,结合平衡状态下物质的平衡浓度计算反应的平衡常数;
(2)依据(1)的计算数据计算得到B的反应速率V=△$\frac{△c}{△t}$,A的转化率=$\frac{消耗量}{起始量}$×100%;
(3)据图判断,反应进行至20min时B的量突然增大,A的物质的量减小,C物质的量增大,依据化学平衡影响因素分析,平衡正向进行,A的转化率增大;
(4)10min到15min的曲线变化,是AB物质的量减小,C的物质的量增大,反应速率增大,但最后达到相同的平衡状态,说明可能的原因是催化剂的作用.
解答 解:(1)由变化量之比等于化学计量数之比可知,a:b:c=2:1:2,平衡状态下ABC的浓度为:c(A)=$\frac{0.8mol}{2L}$=0.4mol/L,c(B)=$\frac{0.4mol}{2L}$=0.2mol/L,c(C)=$\frac{0.2mol}{2L}$=0.1mol/L,平衡状态下物质的平衡浓度计算反应的平衡常数=$\frac{{c}^{2}(C)}{{c}^{2}(A)c(B)}$=$\frac{0.{1}^{2}}{0.{4}^{2}×0.2}$=0.31,故答案为:2:1:2;0.31;
(2)v(B)=$\frac{(0.5-0.4)mol}{2L×15min}$=0.003 3 mol/(L•min),A的转化率为$\frac{(1.0-0.8)mol}{1.0mol}$×100%=20%,故答案为:0.0033 mol/( L•min);20%;
(3)反应进行到20 min时,B的物质的量突然增大,A和C的物质的量瞬时不变,所以是增大了B的量,增大B的量,平衡正向移动,不断消耗A,A的体积分数将减小,故答案为:增大了B的量;减小;
(4)10min到15min的曲线变化,是AB物质的量减小,C的物质的量增大,反应速率增大,但最后达到相同的平衡状态,说明改变的 条件是加入了催化剂,改变反应速率不改变化学平衡,故答案为:使用了催化剂.
点评 本题考查了化学反应速率影响因素,化学反应速率、化学平衡常数的计算,图象分析和化学平衡移动原理是解题关键,题目难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| 实验操作设计 | 现象记录 | 结论解释 | |
| A | 将少量浓硝酸逐滴加入Cu 和稀硫酸的混合物中 | 产生红棕色气体 | 硝酸被还原为NO2 |
| B | 用坩埚钳夹住铝箔在酒精灯 上加热 | 铝箔熔化但并不滴落 | 熔点:Al2 O3>Al |
| C | 向某氯化亚铁溶液中加入 Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化 亚铁溶液已经变质 |
| D | 向紫色石蕊试液中持续长时 间通人氯气 | 溶液先变红,最后变 为无色 | 氯气有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将足量Cl2通入溴化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl- | |
| B. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| C. | AlCl3溶液中通入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 碳酸氢钠和稀硫酸反应:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
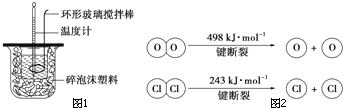 针对化学反应中的能量变化解决下列问题.
针对化学反应中的能量变化解决下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外的电子总是尽先排在能量高的电子层里,然后才排在能量低的电子层 | |
| B. | 某原子的核电荷数与最外层电子数相等 | |
| C. | 原子核外的电子层分为七层,每层所排的电子数相同 | |
| D. | 某原子M层上电子数是L层上电子数的4倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25 | B. | 0.025 | C. | 30.25 | D. | 27.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价] | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | L2+与R2-的核外电子数相等 | D. | M与T形成的化合物具有两性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com