
【题目】下列有关环境、健康及能源的叙述中,不正确的是
A. 氮的氧化物是光化学烟雾的主要污染物,二氧化碳是温室效应的主要污染物,所以它们的含 量是空气质量报告的主要项目
B. PM2.5表面积大,能吸附大量的有毒有害的物质,对人的肺功能造成很大伤害
C. 聚乙烯是生产食品保鲜膜、塑料水杯等生活用品的主要材料,不能用聚氯乙烯替代
D. 利用催化转化装置可以将汽车尾气中的NOx、CO等有害气体转化为N2、CO2等无害气体
科目:高中化学 来源: 题型:
【题目】用磁铁矿(主要成分Fe3O4、含Al2O3和SiO2等杂质),制取高纯铁红的工艺流程如下。
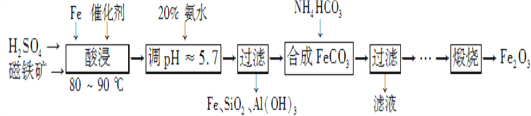
(1) 酸浸时,采用80-90℃的原因_______________________________________________;
铁粉的作用是____________________________________。
(2) 合成碳酸亚铁的离子方程式__________________________________________________________________。
(3) 图中“滤液”中主要阳离子是_______________________________________________________________;
(4)为了测定磁铁矿中铁的含量,称取80 g的磁铁矿样品加入足量稀硫酸使其充分溶解,过滤,得溶液100mL,取20mL溶液在酸性条件下用0.4 mol·L-1 KMnO4溶液滴定,当溶液中Fe2+ 全部被氧化时,消耗KMnO4溶液体积 10.00 mL。(已知MnO4-被还原为Mn2+)
①写出滴定时反应的离子方程式__________________________________________
②当溶液中Fe2+ 全部被氧化时,c(Fe3+)=_____________________mol·L-1, (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。某化学兴趣小组对食盐与亚硝酸钠进行探究。
I.鉴别NaCl和NaNO2。
(1)用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2呈碱性。该溶液呈碱性的原因是_____________________________________(用离子方程式解释)。
(2)已知:Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10。分别向盛有5mL0.0001mol/L两种盐溶液的试管中逐滴滴加0.0001mol/L的硝酸银溶液,先生成沉淀的是装有____________溶液的试管。
(3)已知:2NaNO2+4HI==2NaI+I2+2NO↑+2H2O。根据这一反应,可以用试剂和生活中的常见物质鉴别亚硝酸钠和食盐,进行实验时,必须选用的物质有____________(填选项字母)
A.自来水 B.碘化钾溶液 C.淀粉 D.白糖 E.食醋 F.白酒
Ⅱ.NaNO2与酸反应。
已知:NO+NO2+2NaOH=2NaNO2+H2O。某同学据此认为NaNO2可与硫酸反应,且有NO和NO2生成,并欲用如图所示仪器 (夹持装置己省略)及药品,验证自己的假设。已知沸点:NO2为21℃,NO为-151℃。
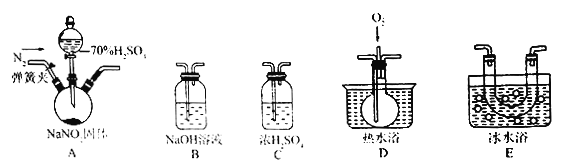
(1)按气流从左到右的方向,上述装置的连接顺序为A→___________→B。
(2)反应前,先打开弹簧夹,通入一段时间氮气,其目的是___________________________。
(3)关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生了红棕色气体。
①依据__________现象,可确认产物中有NO。
②裝置E的作用是______________________ 。
(4)如果没有装置C,对实验结论的影响是______________________________________。
(5)综合以上信息推断,NO2与NaOH溶液发生反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属元素性质的叙述中正确的是( )
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正化合价
C.金属元素在自然界中全部以化合态存在
D.金属元素的单质在常温下均为固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态Cl原子核外电子占有的原子轨道数为______个,P、S、Cl的第一电离能由大到小顺序为_______。
(2)PCl3分子中的中心原子杂化轨道类型是______,该分子构型为_______。
(3)PH4Cl的电子式为______,Ni与CO能形成配合物Ni(CO)4,该分子中π键与σ键个数比为________。
⑷己知MgO与NiO的晶体结构(如图1)相同,其中Mg2+和Ni2+的离子半径分别为66 Pm和 69 pm,则熔点:MgO___NiO(填“>”、“<”或“=”),理由是______。
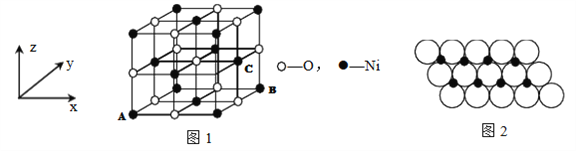
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为______。
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列, Mi2+填充其中(如图2),己知O2-的半径为a m,每平方米面积上分散的该晶体的质量为____g。(用a、NA表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com