
【题目】高纯度氧化铝有广泛的用途,某研究小组研究用以下流程制取高纯度氧化铝:
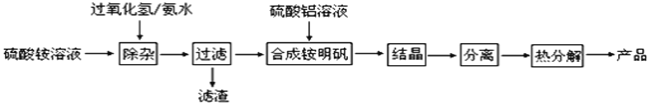
(1)“除杂”操作是加入H2O2后,然后用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中少量的Fe2+。
①酸性溶液中Fe2+与H2O2反应的离子方程式为___。
②过滤操作中所得到滤渣主要成分的化学式为___。
(2)检验上述流程中“过滤”后杂质是否除尽的实验方法___。
(3)配制硫酸铝溶液时,需用硫酸酸化的目的是___。
(4)“结晶”操作中,得到铵明矾晶体(NH4Al(SO4)212H2O),采用的操作是___。
(5)铵明矾晶体的化学式为NH4Al(SO4)212H2O,在0.1mol/L铵明矾的水溶液中,c(NH4+)、c(Al3+)、c(SO42﹣)三种离子浓度由大到小的顺序为___。
Kb(NH3·H2O)=1.8×10-5KbAl(OH)3=1.38×10-9
(6)向铵明矾溶液中加入过量NaOH溶液,反应的离子方程式为___。
【答案】2Fe2++H2O2+2H+===2Fe3++2H2O Fe(OH)3 取少量滤液于试管中,滴入几滴KSCN溶液,若溶液未变成红色,说明杂质已经除尽,反之则没有除尽 抑制Al3+的水解 母液经蒸发浓缩至溶液表面刚好出现薄层晶体即停止加热,然后冷却结晶 c(SO42-)>c(NH4+)>c(Al3+) Al3++NH4++5OH-===AlO2-+NH3·H2O+2H2O
【解析】
根据工艺流程分析可知,“除杂”过程中Fe2+先被H2O2氧化为Fe3+,用氨水调节溶液的pH为8.0,Fe3+转化为Fe(OH)3沉淀,过滤得到滤渣为Fe(OH)3沉淀,滤液中的主要离子为NH4+、SO42-,向滤液中加入硫酸铝溶液合成铵明矾,通过结晶析出铵明矾晶体,过滤分离出晶体,再加热即可得到高纯度的氧化铝,据此分析回答问题。
(1)①“除杂”过程中Fe2+被酸性条件下的H2O2氧化为Fe3+,由氧化还原反应规律可的其离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+===2Fe3++2H2O;
②用氨水调节溶液的pH为8.0,Fe3+转化为Fe(OH)3沉淀,反应的离子方程式为Fe3++3NH3·H2O===Fe(OH)3↓+3NH4+,则滤渣为Fe(OH)3沉淀,故答案为:Fe(OH)3;
(2)检验上述流程中“过滤”后杂质是否除尽,即检验Fe3+是否存在,可用KSCN试剂检验,方法为:取少量滤液于试管中,滴入几滴KSCN溶液,若溶液未变成红色,说明杂质已经除尽,反之则没有除尽,故答案为:取少量滤液于试管中,滴入几滴KSCN溶液,若溶液未变成红色,说明杂质已经除尽,反之则没有除尽;
(3)硫酸铝溶液中,Al3+发生水解反应:Al3++3H2O![]() Al(OH)3↓+3H+,加入硫酸酸化可使水解平衡逆向移动,抑制Al3+的水解,故答案为:抑制Al3+的水解;
Al(OH)3↓+3H+,加入硫酸酸化可使水解平衡逆向移动,抑制Al3+的水解,故答案为:抑制Al3+的水解;
(4)“结晶”操作中,为避免可溶性杂质析出,Al3+的水解,防止晶体失去结晶水,母液需经蒸发浓缩至溶液表面刚好出现薄层晶体即停止加热,然后冷却结晶得到铵明矾晶体,故答案为:母液经蒸发浓缩至溶液表面刚好出现薄层晶体即停止加热,然后冷却结晶;
(5)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L铵明矾的水溶液中,c(SO42-)=0.2mol/L,未水解前c(Al3+)=c(NH4+)=0.1mol/L,由于NH4+和Al3+均水解,且因为Kb(NH3·H2O)=1.8×10-5>KbAl(OH)3=1.38×10-9,NH3·H2O的碱性大于Al(OH)3的碱性,所以Al3+的水解大于NH4+,则c(SO42-)>c(NH4+)>c(Al3+),故答案为:c(SO42-)>c(NH4+)>c(Al3+);
(6)向铵明矾溶液中加入过量NaOH溶液,Al3+转化为AlO2-,NH4+转化为NH3·H2O,反应的离子反应方程式为:Al3++NH4++5OH-===AlO2-+NH3·H2O+2H2O,故答案为:Al3++NH4++5OH-===AlO2-+NH3·H2O+2H2O。


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]____________;下列状态的铝元素中,电离最外层的一个电子所需能量最小的是______________(填标号)。
A. B.
B.![]() C.
C.![]() D.
D.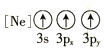
(2)8—羟基喹啉合铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与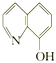 8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
①表格中卤化物的熔点产生差异的原因是_______________________________________________。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6分子,分子中每个原子最外层均达到8电子,二聚体Al2Cl6的结构式为______________________________;其中Al的配位数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、W、X、Y、Z五种短周期元素在周期表中的相对位置如下图所示,其中W的单质是一种重要半导体材料。
|
|
| Y |
|
Q | W | X |
| Z |
请按要求回答下列问题:
(1)Y的原子结构示意图为________;举一例说明Z的非金属性比X的非金属性强的事实:________。
(2)W、X、Y的原子半径由大到小依次![]() 填元素符号
填元素符号![]() ________:W与Z形成的化合物电子式为________。
________:W与Z形成的化合物电子式为________。
(3)将Z的单质通入到含等物质的量FeBr2溶液中充分反应的离子方程式为________。
(4)已知: 2Na(s)+![]() Y2(g)=Na2Y(s)H=-414kJ/mol;2Na(s)+Y2(g)=Na2Y2(s)H=-511kJ/mol;则Na2Y(s)转变为Na2Y2(s)的反应一定条件下能自发进行的理由是________。将0.2mol Na2Y2加入到100mL1mol/L的QZ3中,充分反应的化学方程式为________。
Y2(g)=Na2Y(s)H=-414kJ/mol;2Na(s)+Y2(g)=Na2Y2(s)H=-511kJ/mol;则Na2Y(s)转变为Na2Y2(s)的反应一定条件下能自发进行的理由是________。将0.2mol Na2Y2加入到100mL1mol/L的QZ3中,充分反应的化学方程式为________。
(5)R与W同周期,已知:在T℃时Ksp[R(OH)2]的值为4.0×10-12,则R(OH)2饱和溶液中c(OH-)=________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告中提出要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如下,当该装置工作时,下列说法正确的是
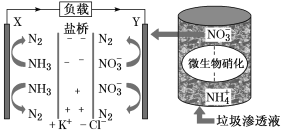
A.盐桥中Cl-向Y极移动
B.电路中流过7.5 mol电子时,共产生标准状况下N2的体积为16.8L
C.电流由X极沿导线流向Y极
D.Y极发生的反应为2NO3-+10e-+6H2O===N2↑+12OH—,周围pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将CO2通入2LpH=12的KOH溶液中,溶液中水电离的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如下图所示。下列叙述不正确的是
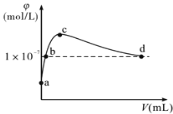
A.a点溶液中:水电离出的c(H+)=1×10-12mol/L
B.b点溶液中:c(H+)=1×10-7mol/L
C.c点溶液中:c(K+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.d点溶液中:c(K+)=2c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是
A.再通入少量氯气,c(H+)/c(ClO-)减小
B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量水,水的电离平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,1mol·L-1的CH3COOH溶液与1mol·L-1的NaOH溶液等体积混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.在含有酚酞的0.1mol/L氨水中加入少量的NH4Cl晶体,溶液颜色变浅
C.氢硫酸的电离方程式为:H2S![]() 2H++S2﹣
2H++S2﹣
D.0.1mol/LNa2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是
①KHCO3 ②(NH4)2CO3③Al2O3④Al(OH)3
A.全部B.只有①③④C.只有③④D.只有②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com