
��֪��ӦA(g)+B(g)  C(g)+D(g)��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���±���ʾ��830��ʱ����һ��2L���ܱ������г���0.20molA��0.80molB��4s��v(A)=0.005 mol��L-1��S-1��
C(g)+D(g)��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ���±���ʾ��830��ʱ����һ��2L���ܱ������г���0.20molA��0.80molB��4s��v(A)=0.005 mol��L-1��S-1��
����˵����ȷ����( )
�¶�/�� | 700 | 830 | 1200 |
Kֵ | 1.7 | 1.0 | 0.4 |
A.4sʱ��c(B)Ϊ0.76 mol��L-1
B. 830�浽ƽ��ʱ��A��ת����Ϊ80%
C. ��ƽ��ʱ�������¶ȣ�ƽ�������ƶ�
D.1200 ��ʱ��ӦC(g)+D(g)  A(g)+B(g)��ƽ�ⳣ����ֵΪ0.4
A(g)+B(g)��ƽ�ⳣ����ֵΪ0.4
 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ��һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��Ԫ�����ڱ���һ���֣�����Ԫ��X��Y��Z��������ȷ���ǣ� ��
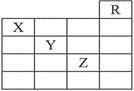
��X����̬�⻯����Y������������Ӧ��ˮ�����ܷ�����Ӧ������
��Y��Z����̬�⻯��ˮ��Һ�ľ�������
��Z�ĵ����ڳ�������Һ��
��Z��ԭ��������Y��19
��Z���ڵ������к���32��Ԫ��
A. �٢ڢۢ� B. �٢ۢܢ�
C. �ڢۢܢ� D. �٢ڢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�ʡ�����и߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ������
����Se����һ���п��������������õ�Ԫ�أ������γɶ��ֻ����
��1����̬��ԭ�ӵļ۲�����Ų�ʽΪ ��
��2���ࡢ�顢���ĵ�һ�����ܴ�С����Ϊ ��
��3��H2SeO3������ԭ���ӻ������� ��SeO32?�����幹���� ����SeO42?��Ϊ�ȵ���ķ����У�дһ�����ʵĻ�ѧʽ���ɣ� ��
��4��H2Se���� ������Ի�Ǽ��ԣ����ӣ����������۵�Ϊ217�棬������ ���塣
��5������п��һ����Ҫ�İ뵼����ϣ��侧���ṹ��ͼ��ʾ�����þ����ܶ�Ϊ��g•cm?3������п��Ħ������ΪM g/mol��NA���������ӵ�������������aΪ pm��
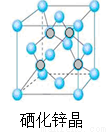
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�ʡ�����и߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����( )
A��NaOH��Ħ������Ϊ40 g
B��1 mol O2��������������Է����������
C��1 mol OH��������Ϊ17 g��mol��1
D��������Ħ������(��λg��mol��1)����ֵ�ϵ����������ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ�����и�һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ������
�о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��1����֪��2SO2(g)+O2(g)  2SO3(g) ��H= -196.6kJ��mol-1
2SO3(g) ��H= -196.6kJ��mol-1
2NO(g)+O2(g)  2NO2(g) ��H= -113.0kJ��mol-1
2NO2(g) ��H= -113.0kJ��mol-1
��ӦNO2(g)+SO2(g)  SO3(g)+NO(g)�Ħ�H= kJ��mol-1
SO3(g)+NO(g)�Ħ�H= kJ��mol-1
��2��һ�������£���NO2��SO2�������2��1�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬����
A����ϵѹǿ���ֲ���
B�����������ɫ���ֲ���
C��SO3��NO������ȱ��ֲ���
D��ÿ����1molSO3��ͬʱ����1mol NO
���������Ӧ��ƽ��ʱNO2��SO2�������Ϊ5��1����ƽ�ⳣ��K=
��3��CO�����ںϳɼ״�����Ӧ����ʽΪCO(g)+2H2(g)  CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��2����ʾ���÷�Ӧ��H 0(�>������)��ʵ����������������250�桢1.3��104kPa���ң�ѡ���ѹǿ�������ǣ� ��
CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��2����ʾ���÷�Ӧ��H 0(�>������)��ʵ����������������250�桢1.3��104kPa���ң�ѡ���ѹǿ�������ǣ� ��
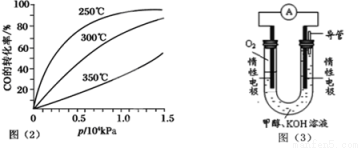
��4������ȼ�յķ�Ӧԭ�����ϳɵļ״����������ͼ��3����ʾ��ԭ���װ�á�
�ٸõ�ع���ʱ��OH-�� ���ƶ�(���������)��
�ڸõ�������ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ�����и�һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
����Ӧ2Fe3++2I-?2Fe2++I2��Ƴ�����ͼ��ʾ��ԭ��ء�
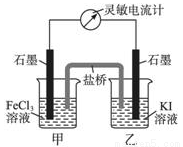
����˵������ȷ����( )
A�������е�K+����FeCl3��Һ
B����Ӧ��ʼʱ������ʯī�缫�Ϸ���������Ӧ
C�������ƶ���Ϊ��ʱ����Ӧ�ﵽ��ѧƽ��״̬
D�������ƶ���Ϊ����ڼ�������FeCl2���壬����ʯī�缫Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ�����и�һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���ж��ڻ�ѧ��Ӧ����˵����ȷ����( )
A.��Ӧ2A(g)+B(g)=3C(s)+D(g)��һ�����������Է����У�˵���÷�Ӧ�ġ�H��0
B.�����·�Ӧ2Na2SO3(s)+O2(g)=2Na2SO4(s)���Է����У����H��0
C.��Ӧ2Mg(s)+CO2(g)=C(s)+2MgO(s)���Է����У���÷�Ӧ�ġ�H��0
D.һ���¶��£���Ӧ2NaCl(s)=2Na(s)+Cl2(g)�ġ�H��0����S��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�긣��ʡ�����и߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ��ѧ�漰���ֳ���������˵����ȷ���ǣ� ��
A���������ʷ�Ӧ������������д��ѧ����ʽ��ƽ�ⳣ������
B��ij�¶��£�2L�ܱ������м���4mol A��2mol B������Ӧ��
3A��g��+2B��g�� 4C��s��+2D��g����ƽ��ʱ���n��C��=1.6mol����Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=
4C��s��+2D��g����ƽ��ʱ���n��C��=1.6mol����Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=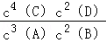
C���¶�һ��ʱ������Һ��c��Ag+ ���� c��Cl��������Kspֵʱ������ҺΪAgCl�ı�����Һ
D�����ܵ����AB2������Һ�У�c��A2+ ��=x mol��L��1��c��B����=y mol��L��1����KspֵΪ4xy2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�����ظ߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA���������ӵ���������ֵ������˵������ȷ����
A��0.1L0.5mol/LCH3COOH��Һ�к��е���������Ϊ0.05NA
B�������£�16gO2��O3�Ļ�������к��е���ԭ����ΪNA
C����״���£�22.4 L NO ��22.4 L O2 ��Ϻ����������з�������Ϊ1.5 NA
D��1molFeCl3���ˮ��Ӧ���ɽ������NA��Fe(OH��3����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com