
| A. | NaHSO4溶液中滴加入Ba(OH)2溶液至中性H++Ba2++OH-+SO42-═BaSO4↓+H2O | |
| B. | 酸性KMnO4溶液与双氧水反应:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 钢铁腐蚀时可能发生的正极反应为:4OH-+4e-═2H2O+O2↑ | |
| D. | 将氯气溶于水制备次氯酸:Cl2+H2O?2H++Cl-+ClO- |
分析 A.溶液为中性时,硫酸氢钠与氢氧化钡的物质的量之比为2:1;
B.酸性高锰酸钾具有强氧化性,能够将双氧水氧化成氧气;
C.钢铁腐蚀时正极氧气得到电子生成氢氧根离子;
D.次氯酸为弱酸,离子方程式中不能拆开.
解答 解:A.NaHSO4溶液中滴加入Ba(OH)2溶液至中性,硫酸氢钠与氢氧化钡按照2:1反应,正确的离子方程式为:2H++Ba2++2OH-+SO42-═BaSO4↓+2H2O,故A错误;
B.酸性KMnO4溶液与双氧水发生氧化还原反应,反应的离子方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,故B正确;
C.钢铁腐蚀时正极发生氧气得到电子发生还原反应,正确的正极反应为:2H2O+O2-4e-=4OH-,故C错误;
D.氯气溶于水生成次氯酸和氯化氢,正确的离子方程式为:Cl2+H2O?H++Cl-+HClO,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸、食盐水 | B. | 氨水、碘酒 | C. | 石灰水、硝酸 | D. | 稀硫酸、食醋 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
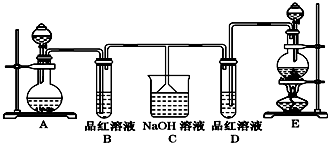
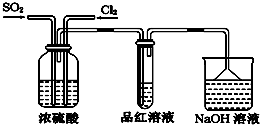
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=12的溶液:NH4+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸变红色的溶液:Na+、Al3+、NO3-、SO42- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | 澄清透明的无色溶液:ClO-、MnO4-、Al3+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是把物质的质量和微观粒子数联系起来的一个基本物理量 | |
| B. | 1摩尔H2SO4的质量为98g/mol | |
| C. | 国际上规定,0.012 kg 碳原子所含有的碳原子数目为 1 mol | |
| D. | 1摩尔氢气分子可以表示为1mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=4 R2+是还原剂 | B. | m=n R3+是氧化产物 | ||
| C. | m=2 R2+是氧化剂 | D. | m=y R3+是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
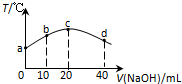 常温下,若往20mL 0.01mol•L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
常温下,若往20mL 0.01mol•L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | 所加烧碱溶液PH=12,c点水的离子积常数KW=10-14 | |
| C. | c点混合溶液中:c(OH-)>c(HNO2) | |
| D. | d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com