
【题目】对温室气体二氧化碳的研究一直是科技界关注的重点。
I.在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一,相关反应如下:
主反应:CO2(g)+4H2(g)=CH4(g)+2H2O(g)
副反应:CO2(g)+H2(g)=CO(g)+H2O(g)
(1)工业上提高甲烷反应选择性的关键因素是____________。
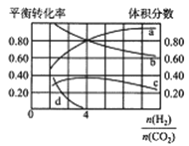
(2)T℃时,若在体积恒为2L的密闭容器中同时发生上述反应,将物质的量之和为5mol的H2和CO2以不同的投料比进行反应,结果如图所示。若a、b表示反应物的转化率,则表示H2转化率的是____________,c、d分别表示CH4(g)和CO(g)的体积分数,由图可知![]() =____________时,甲烷产率最高。
=____________时,甲烷产率最高。
Ⅱ.CO2加氢合成低碳烯烃的技术在节能减排等方面具有重要意义,由CO2和H2合成CH3OH的反应如下:CO(g)+3H2(g)=CH3OH(g)+H2O(g) △H,在10L的恒容密闭容器中投入1molCO2和2.75molH2,在不同条件下发生上述反应,测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
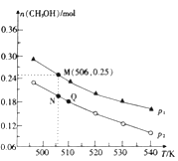
(3)判断P1____________P2 (填“大于”、“小于”或“等于”)
说明理由_____________________________________。
(4)经测定Q点时容器的压强是反应前压强的9/10,若反应从开始到平衡所需的时间为5min,则05min内H2的反应速率v(H2)=____________。
【答案】 催化剂 b 4 大于 此反应正向是气体分子总数缩小的反应,在相同温度下,压强越大,正向进行程度越大,生成甲醇越多 v(H2)=1.125×l0-2mol/(L·min)
【解析】(1)催化剂能加快化学反应速率,并且具有选择性,故工业上提高甲烷反应选择性的关键因素是催化剂,故答案为:催化剂;
(2)反应物有两种以上的,增大一种反应物浓度可以提高另一种反应物的转化率,本身转化率降低,依据图象可知, ![]() 增大,则氢气的转化率减小,因此b曲线为氢气转化率曲线;由图可知,横坐标
增大,则氢气的转化率减小,因此b曲线为氢气转化率曲线;由图可知,横坐标![]() =4时,c曲线达到最高,即甲烷的体积分数最大,故答案为:b;4;
=4时,c曲线达到最高,即甲烷的体积分数最大,故答案为:b;4;
(3)该反应的正反应为气体体积减小的反应,温度一定时,增大压强,平衡向正反应方向移动,甲醇的物质的量增大,故压强P1>P2,故答案为:>;此反应正向是气体分子总数缩小的反应,在相同温度下,压强越大,正向进行程度越大,生成甲醇越多;
(4)设转化的二氧化碳的浓度为x
根据反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)
起始(mol/L) 0.10.275 0 0
转化(mol/L) x 3x x x
平衡(mol/L) 0.1-x0.275-3xx x
根据压强为反应前的![]() 可以列出表达式
可以列出表达式![]() =
=![]() ,可以计算出x=0.01875 mol/L,V(H2)=
,可以计算出x=0.01875 mol/L,V(H2)= ![]() =
=![]() =1.125×10-2mol/(Lmin),故答案为1.125×10-2mol/(Lmin)。
=1.125×10-2mol/(Lmin),故答案为1.125×10-2mol/(Lmin)。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用盐酸和硝酸银探究铁、铜、银的金属活动顺序,下列实验可以不需要进行的是( )
A. 铁+稀盐酸 B. 铜+稀盐酸 C. 银+稀盐酸 D. 铜+硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第33号元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)砷在元素周期表中的位置是__________________________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式_________________________________________。该反应需要在加压下进行,原因是__________________________。
(3)已知:2As(s)+3H2(g)+4O2(g)=2H3AsO4(s)△H1
H2(g)+ ![]() O2(g)=H2 O(l) △H2
O2(g)=H2 O(l) △H2
2As(s)+ ![]() O2(g) =As2O5(s)△H3
O2(g) =As2O5(s)△H3
则反应 As2O5(s) +3H2O(1)= 2H3AsO4(s)的△H=____________。
(4)298K时,将20mL3xmol·L-1Na3AsO3、20 mL 3xmol·L-1I2和20mL NaOH溶液混合,发生反应:AsO33-(aq)+I2+2OH-![]() AsO43-+2I-+H2O。溶液中c(AsO43-) 与反应时间(t)的关系如图所示。
AsO43-+2I-+H2O。溶液中c(AsO43-) 与反应时间(t)的关系如图所示。
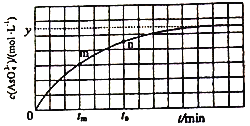
①下列不能判断反应达到平衡的是________(填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.c(AsO43-)/c(AsO33-)不再变化 d.c(I-)=ymol·L-1
②tm时v逆 ______tn时v逆(填“>”“<”或“=”),理由是_____________。
③若平衡时溶液的c(OH-)=lmol/L,则该反应的平衡常数K为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将新制的氢氧化铜溶液加入某人的尿液中,加热后,如果观察到砖红色沉淀出现,则此人尿液中含有( )
A. 食醋 B. 食盐 C. 葡萄糖 D. 蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是( )
A.Na和O2 B.NaOH和CO2
C.Na2O2和CO2 D.NaHCO3和Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g),CO2的平衡浓度c(CO2)与温度T的关系如图所示。下列说法错误的是

A. 反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的 ΔH>0
CO2(g)+H2(g)的 ΔH>0
B. 在T2时,若反应处于状态D,则一定有ν正>ν逆
C. 平衡状态A与C相比,平衡状态A的c(CO)大
D. 若T1、T2时的平衡常数分别为K1、K2,则K1<K2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com