
| A. | x等于6 | |
| B. | 性质稳定,不易脱色 | |
| C. | 易溶解于强酸和强碱 | |
| D. | 可用氧化物形式表示为BaO•CuO•2SiO2 |
分析 A.化合物中正负化合价的倒数和为0;
B.由信息可知,硅酸盐性质稳定;
C.硅酸盐不与强酸、强碱反应;
D.硅酸盐以氧化物的形式表示,按照活泼金属氧化物.较不活泼金属氧化物.二氧化硅.水的形式书写,遵循质量守恒定律.
解答 解:A.硅酸铜钡(BaCuSi2Ox,铜为+2价),Ba为+2价,Si为+4价,则+2+2+(+4)×2+(-2)×x=0,解得x=6,故A正确;
B.由信息可知,硅酸盐性质稳定,颜色不易褪色,如蓝紫色的硅酸铜钡不易脱色,故B正确;
C.硅酸盐不与强酸、强碱反应,性质稳定,故C错误;
D.BaCuSi2O6以氧化物的形式表示为BaO•CuO•2SiO2,故D正确;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握习题中的信息及硅酸盐的性质为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.125mol/L | B. | 0.175 mol/L | C. | 0.25 mol/L | D. | 0.50 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
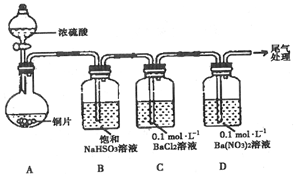
| 序号 | 实验操作 | 实验现象 |
| 1 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
| 2 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
| 3 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
| 序号 | 实验操作 | 实验现象 |
| 4 | 取0.3g纯净Na2SO3和1.17gNaCl固体混合物,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放电时,正极区的pH增大 | |
| B. | 放电时,负极的电极反应式为PbO4+4H++2e-═Pb2++2H2O | |
| C. | 充电时,铅电极与电源的正极相连 | |
| D. | 充电时,当阴极生成20.7g Pb时溶液中有0.2mol电子通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,Cu(OH)2 在水中的溶度积比其在 Cu(NO3)2 溶液中的大 | |
| B. | 一定温度下,将 0.10 mol/L的氨水加水稀释,溶液中各离子浓度均减小 | |
| C. | H3PO2 属于一元弱酸,则 H3PO2 与过量 NaOH 溶液反应的离子方程式为:H3PO2+3OH?═PO23-+3H2O | |
| D. | 常温下,NaHS 溶液中:c(H+)+c(H2S)═c(S2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
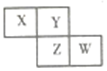 如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )
如图是从元素周期表中截取的一部分,已知X、Y、Z、W四种短周期主族元素,下列说法中正确的是( )| A. | W的原子序数不可能是X的原子序数的3倍 | |
| B. | Z元素可能为金属 | |
| C. | 四种元素的原子有可能均能与氢原子形成18电子分子 | |
| D. | W的气态氢化物的稳定性一定比Y的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、油脂、蛋白质在一定条件下都可以发生水解反应 | |
| B. | 溴苯分子中苯环上的一个氢原子被-C4H9原子团取代形成的同分异构体共有12种 | |
| C. | 等物质的量的乙烯和乙醇在氧气中充分燃烧后耗氧量相同 | |
| D. | 甲烷中混有乙烯可以使用溴的四氯化碳溶液或酸性KMnO4溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b g | B. | $\frac{3b}{4}$g | C. | $\frac{b}{2}$g | D. | $\frac{b}{4}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com