
分析 (1)常见的原子晶体有:一些非金属单质,如金刚石、硼、硅、锗等;一些非金属化合物,如二氧化硅、碳化硅、氮化硼等;
(2)常见的分子晶体有:一些非金属单质,如白磷、硫磺和气体单质;一些非金属氧化物,如二氧化碳、二氧化硫等;
(3)含共价键的离子晶体是离子化合物,但其中含共价键.
解答 解:A.NaOH是离子化合物,其中既含共价键又含离子键,属于离子晶体;
B.二氧化硅是原子晶体,只含共价键;
C.金刚石是单质,为原子晶体;
D.NaCl是离子晶体,只含离子键;
E.P4是分子晶体,分子内只含共价键,分子间为分子间作用力;
F.干冰即CO2,为分子晶体,分子内只含共价键,分子间为分子间作用力;
G.晶体硅Si是原子晶体,原子间以共价键结合;
H.氧化镁MgO是离子晶体,只含离子键;
I.晶体氩Ar是分子晶体,由于是单原子分子,故分子内无任何化学键,分子间有分子间作用力.
(1)属于原子晶体的化合物是B,故答案为:B;
(2)属于分子晶体的化合物是F,故答案为:F;
(3)含共价键的离子晶体是A,故答案为:A.
点评 本题考查晶体类型的判断、化学键类型的判断等,难度不大,注意知识的积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | 元素性质或原子结构 |
| T | M层上的电子数为6个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7 |
| A. | 元素X的一种同位素可测定文物年代,这种同位素的符号是12C | |
| B. | 元素Z的非金属性比元素T弱 | |
| C. | Y和T位于同一主族 | |
| D. | T、X、Y、Z四种元素的最高价氧化物水化物中化学性质明显不同于其它三种的是碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式为:5MnO2+2e-═Mn5O102- | |
| B. | 每生成1 mol AgCl转移2 mol电子 | |
| C. | 工作时,电子由MnO2极经外电路流向Ag极 | |
| D. | Ag发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③正确 | B. | 只有③正确 | C. | ①②③④正确 | D. | ①②③正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 组别 | 被提纯物质 | 杂质 | 除杂试剂 | 除杂操作 |
| A | CO2 | SO2 | Na2CO3溶液 | 洗气 |
| B | 乙酸乙酯 | 乙酸 | 乙醇和浓H2SO4 | 加热 |
| C | 乙烷 | 乙烯 | 溴水、碱石灰 | 洗气 |
| D | 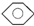 | CH3CH2OH | H2O | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
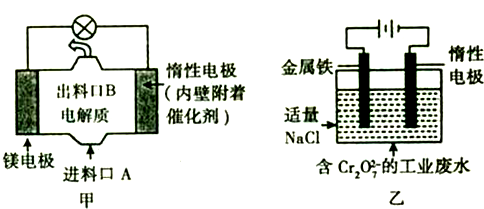
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com