

���� SnCl2���������ܽ⣬�ټ������ۣ��ܽ�õ�SnCl2��Һ����̼���Ƴ��������ӣ����˵õ�����ϴ�Ӻ���������ܽ�õ���������Һ������Ũ����ȴ�ᾧ������ϴ�ӵõ����������壬
��1����ԭ�ӵĺ˵����Ϊ50����̼Ԫ������ͬһ���壬���ڢ�A�壬����ԭ������������������Ԫ������ȷ�����ڵ����ڣ�
��2��������ͼ��֪���������Ǵ���Һ�еõ����ᾧˮ�ľ��壬ֻ�ܲ�ȡ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӵõ���
��3������Ϣ��֪��SnCl2��ˮ�����ɼ�ʽ�Ȼ��������������ᣬ����Sn2+ˮ�⣻
��4������Ϣ��֪��Sn2+�ױ�����������Sn�۳�������ҺpH�⣬����ֹSn2+��������
��5�����������£�SnSO4����������˫��ˮȥ������˫��ˮ��ǿ�����ԣ���Sn2+�ױ�����ΪSn4+����������ԭΪˮ��
��6�����ݵ���ת���غ��뷽��ʽ�ɵù�ϵʽSn��Sn2+��2Fe3+��2Fe2+��$\frac{1}{3}$K2Cr2O7���ݴ˼��㣮
��� �⣺SnCl2���������ܽ⣬�ټ������ۣ��ܽ�õ�SnCl2��Һ����̼���Ƴ��������ӣ����˵õ�����ϴ�Ӻ���������ܽ�õ���������Һ������Ũ����ȴ�ᾧ������ϴ�ӵõ����������壬
��1����Ԫ����̼Ԫ������ͬһ���壬���ڢ�A�壬ԭ�Ӻ˵����Ϊ50����50-2-8-8-18=14����Sn���ڵ������ڣ��������ڱ��е�λ��Ϊ���������ڵڢ�A�壬
�ʴ�Ϊ���������ڵڢ�A�壻
��2��������ͼ��֪���������Ǵ���Һ�еõ����ᾧˮ�ľ��壬ֻ�ܲ�ȡ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӵõ���
�ʴ�Ϊ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӣ�
��3������Ϣ��֪��SnCl2��ˮ�����ɼ�ʽ�Ȼ�����������ƽ��Sn Cl2+H2O?Sn��OH��Cl+HCl���������ᣬʹ��ƽ�������ƶ�������Sn2+ˮ�⣬
�ʴ�Ϊ��SnCl2ˮ�⣬����SnCl2+H2O?Sn��OH��Cl+HCl���������ᣬʹ��ƽ�������ƶ�������Sn2+ˮ�⣻
��4������Ϣ��֪��Sn2+�ױ�����������Sn�۳�������ҺpH�⣬����ֹSn2+��������
�ʴ�Ϊ����ֹSn2+��������
��5�����������£�SnSO4����������˫��ˮȥ������˫��ˮ��ǿ�����ԣ���Sn2+�ױ�����ΪSn4+����������ԭΪˮ�����ӷ���ʽΪ��Sn2++H2O2+2H+�TSn4++2H2O��
�ʴ�Ϊ��Sn2++H2O2+2H+�TSn4++2H2O��
��6����������������������Ϊx����
Sn��Sn2+��2Fe3+��2Fe2+��$\frac{1}{3}$K2Cr2O7���㣮
119g $\frac{1}{3}$mol
1.226g��x 0.100mol/L��0.032L
��$\frac{119g}{1.226xg}$=$\frac{\frac{1}{3}mol}{0.100mol/L��0.032L}$�����x=93.2%��
�ʴ�Ϊ��93.2%��
���� ����SnSO4�Ʊ���֮��Ϊ���壬����ѧ���Թ������̵����⡢���ʵķ����ᴿ���Ķ���Ŀ��ȡ��Ϣ�����������û�ѧ������д���ζ�Ӧ�ü����ù�ϵʽ���еļ���ȣ��Ѷ��еȣ���ѧ���Ļ���֪ʶ���������нϸߵ�Ҫ��


 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
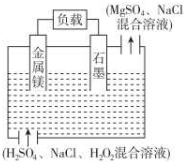 þ-������������һ�����͵ĸ����ܵ�Դ����ṹ��ͼ��ʾ������˵������ȷ���ǣ�������
þ-������������һ�����͵ĸ����ܵ�Դ����ṹ��ͼ��ʾ������˵������ȷ���ǣ�������| A�� | þ���õ�Դ������������ӦMg-2e-�TMg2+ | |
| B�� | �õ�ط�Ӧ����ʽ��Mg+H2O2+2H+�TMg2++2H2O | |
| C�� | �ŵ�ʱ��Һ�е�Cl-�������ƶ� | |
| D�� | �ŵ�ʱ������Χ��Һ��pH���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �����̿���Ϊ�������Ӽ��������ʣ�Ҳ������ijЩ��ѧ��Ӧ�Ĵ�����������ˮ���������Ҵ�����ҵ�ϳ������̿���Ҫ�ɷ�ΪMnO2������MgSO4�����ʣ��Ʊ������̣�����������£�
�����̿���Ϊ�������Ӽ��������ʣ�Ҳ������ijЩ��ѧ��Ӧ�Ĵ�����������ˮ���������Ҵ�����ҵ�ϳ������̿���Ҫ�ɷ�ΪMnO2������MgSO4�����ʣ��Ʊ������̣�����������£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.0 mol•L-1��KNO3��Һ�У�H+��Fe2+��Cl-��SO42- | |
| B�� | ʹ���ȱ��ɫ����Һ�У�Mg2+��Cu2+��SO42-��NO3- | |
| C�� | 0.1 mol•L-1��NaOH��Һ�У�Na+��NH4+��Cl-��HCO3- | |
| D�� | ˮ�����c��H+��=1��10-13mol•L-1����Һ�У�Ca2+��K+��ClO-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 30mL | B�� | 70mL | C�� | 90mL | D�� | 140mL |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com