
分析 依据燃烧热的热化学方程式结合盖斯定律计算所需热化学方程式,根据热化学方程式计算.
解答 解:已知CH4、H2和CO的燃烧热分别为890.3kJ•mol-1、285.8kJ•mol-1、283.0kJ•mol-1,热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
依据盖斯定律①-②×2-③×2得到:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247KJ/mol,
则生成1m3(标准状况)CO物质的量=$\frac{1000L}{22.4L/mol}$,所需热量=$\frac{\frac{1000}{22.4}mol×247KJ}{2mol}$=5.52×103kJ,
答:生成1m3(标准状况)CO所需热量为5.52×103kJ.
点评 本题考查了燃烧热概念和热化学方程式的书写计算应用,掌握概念实质和热化学方程式书写方法是解题关键.题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 加水稀释到100L | B. | 与0.1L pH=11的碱溶液混合 | ||
| C. | 加入一定量酸 | D. | 加入一定量碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
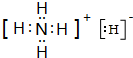 该物质能与水剧烈反应生成两种气体,两种气体的化学式分别是NH3、H2
该物质能与水剧烈反应生成两种气体,两种气体的化学式分别是NH3、H2查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 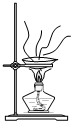 用装置蒸发、结晶制取粗盐 | B. | 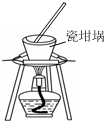 用装置加热熔融NaOH固体 | ||
| C. | 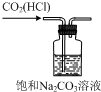 用装置除去CO2中的少量HCl | D. | 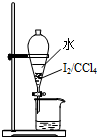 用装置进行萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| B. | 酸性介质中KMnO4氧化H2O2:2MnO${\;}_{4}^{-}$+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH${\;}_{4}^{+}$+Al5++SO${\;}_{4}^{2-}$+Ba2++4OH-═BaSO4↓+Al(OH)5↓+NH5•H2O | |
| D. | 铅蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [N(CH3)4]+中只含共价键 | B. | 该反应中,SO2作氧化剂 | ||
| C. | SO2漂白品红是利用其强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com