
【题目】如图是实验室制备气体和验证气体性质的装置图。
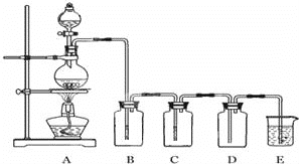
若利用如图装置实现碳和浓硫酸的反应,并进行如下验证:
①装置B、C、D、E中分别装有品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,则D装置中品红溶液的作用是______,证明气体中有CO2的现象是______。
②若证明SO2具有氧化性,同时证明碳酸的酸性比硅酸的强,B、C、D中分别装有Na2S溶液、足量酸性KMnO4溶液、品红溶液。
则:B中的现象______,E中应加入______溶液,E中发生反应的离子方程式为______。
【答案】验证SO2是否除净 D装置中品红不褪色,E装置中溶液变浑浊 有黄色沉淀 Na2SiO3 SiO32-+H2O+CO2=H2SiO3↓+CO32-
【解析】
①该装置为碳和浓硫酸的反应装置,那么A为发生装置,发生的反应为C+2H2SO4![]() CO2↑+2SO2↑+2H2O;B装置中盛放品红,产物通入品红过后品红褪色,证明碳和浓硫酸反应的产物中含有SO2,将气体通入盛放酸性KMnO4溶液的洗气瓶,酸性KMnO4溶液褪色,将SO2吸收,再将产物通入品红溶液中,检验SO2是否被完全吸收,若完全吸收,将剩余物质通入澄清石灰水中,验证产物CO2的存在,据此回答问题。
CO2↑+2SO2↑+2H2O;B装置中盛放品红,产物通入品红过后品红褪色,证明碳和浓硫酸反应的产物中含有SO2,将气体通入盛放酸性KMnO4溶液的洗气瓶,酸性KMnO4溶液褪色,将SO2吸收,再将产物通入品红溶液中,检验SO2是否被完全吸收,若完全吸收,将剩余物质通入澄清石灰水中,验证产物CO2的存在,据此回答问题。
②将碳和浓硫酸反应的产物通入Na2S溶液,SO2与Na2S反应,生成不溶于水的S单质,将产物通入足量酸性KMnO4溶液可将SO2吸收,用品红验证SO2是否被完全吸收,将CO2通入硅酸钠溶液中,利用强酸制弱酸原理,验证碳酸的酸性强于硅酸。
①D装置中品红溶液用于验证SO2是否被完全吸收;当D中品红溶液不褪色,E中澄清石灰水变浑浊说明反应中有CO2生成;
②将碳和浓硫酸反应的产物通入Na2S溶液,SO2与Na2S反应,生成不溶于水的S单质,因此B中能看到有淡黄色沉淀生成,F中加入Na2SiO3溶液,若将CO2通入Na2SiO3溶液中,看到有白色胶状沉淀生成,说明生成了硅酸,利用强酸制弱酸原理可知碳酸的酸性强于硅酸,发生的离子反应为:SiO32-+H2O+CO2=H2SiO3↓+CO32-。
流程设计 |
| |||
实验装置 |
| |||
所选试剂 | 品红溶液 | 酸性KMnO4溶液 | 品红溶液 | 澄清石灰水 |
预期现象 | 褪色 | 褪色 | 不褪色 | 变浑浊 |
注意事项:有时为了简化装置,可将除去SO2和检验SO2是否除尽合并为一个装置,并使用较浓的酸性KMnO4溶液,现象为酸性KMnO4溶液的颜色变浅。 | ||||


科目:高中化学 来源: 题型:
【题目】如图所示是某化学兴趣小组根据教材知识设计的证明Na2CO3与NaHCO3热稳定性的套管实验。下列叙述中不正确的是( )
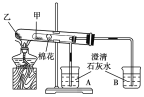
A. 甲为NaHCO3,乙为Na2CO3
B. 要证明NaHCO3受热能产生水,可在小试管内放置沾有少量无水硫酸铜粉末的棉花球
C. 加热不久就能看到A烧杯中的澄清石灰水变浑浊
D. 整个实验过程中A烧杯中的澄清石灰水不会变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸(密度为1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸480mL。
(1)选用的主要仪器有:量筒、玻璃棒、胶头滴管、烧杯、_______。
(2)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4 B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线 D.洗净所用仪器
E.稀释浓H2SO4 F.将溶液转入容量瓶
其操作正确的顺序依次为_______。
(3)简要回答下列问题:
①所需浓硫酸的体积为_______mL。
②如果实验室有15mL、20mL、50mL的量筒应选用_____mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度____(“偏高”、“偏低”、“无影响”)。
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是_____,若搅拌过程中有液体溅出结果会使浓度偏______。
④在转入容量瓶前烧杯中液体应______,否则会使浓度偏_______;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度_______。
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度_____;仰视则使浓度______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
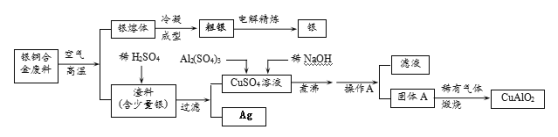
(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将20 g NaOH固体溶于水配成100 mL溶液,其密度为1.185 g·mL-1。
(1)该溶液中NaOH的物质的量浓度为______mol·L-1。
(2)从该溶液中取出10 mL,其中NaOH的物质的量浓度为_____ mol· L-1,含NaOH的物质的量为______mol。
(3)将取出的10 mL溶液加水稀释,稀释后溶液中NaOH的物质的量浓度为1 mol·L-1,稀释后溶液体积为___ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】围绕下列几种物质:①铝、②Al2O3、③稀硝酸、④H2SO4、⑤Ba(OH)2固体、⑥稀氨水、⑦Al2(SO4)3、⑧NaOH溶液、⑨NaHCO3溶液,按要求回答下列问题:
(1)既能与强酸反应,又能与强碱反应的是_____________(填序号);
(2)属于电解质的是_____________(填序号);
(3)写出最适宜制取Al(OH)3的离子方程式_____________;
(4)两物质间发生反应的离子方程式为H++OH-=H2O,请写出该反应的化学方程式_____________;
(5)写出①和⑧反应的离子方程式________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
B. 增大压强可加快SO2转化为SO3的速率
C. 黄绿色的氯水光照后颜色变浅
D. 在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某密闭容器中,可逆反应:A(g) + B(g)![]() xC(g)符合图中(Ⅰ)所示关系:
xC(g)符合图中(Ⅰ)所示关系:![]() (C)表示C气体在混合气体中的体积分数。由此判断,对图像 (Ⅱ) 说法不正确的是:
(C)表示C气体在混合气体中的体积分数。由此判断,对图像 (Ⅱ) 说法不正确的是:
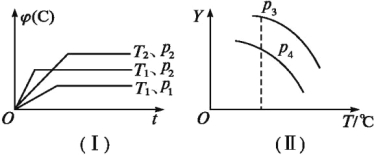
A.p3>p4,Y轴表示A的转化率
B.p3>p4,Y轴表示B的质量分数
C.p3>p4,Y轴表示B的转化率
D.p3>p4,Y轴表示混合气体的平均相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com