
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
科目:高中化学 来源: 题型:选择题
| A. | “低碳生活”是指生活中尽量使用含碳量较低的物质 | |
| B. | 燃煤中加入CaO后可减少酸雨的发生及温室气体的排放 | |
| C. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 | |
| D. | 鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
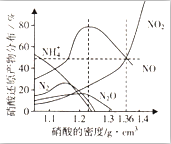 某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )
某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )| A. | 稀硝酸与铁反应,一定有NO生成 | |
| B. | 密度小于1.1g•cm-3的硝酸与铁反应,还原产物百分率最多的是NH4+ | |
| C. | 某硝酸试剂瓶的标签注明:密度为1.26g•cm-3,质量分数50.0%;若取该试剂10ml配成100ml溶液,所得溶液pH=1 | |
| D. | 当硝酸的密度为1.36g•cm-3时,过量铁与硝酸反应,消耗的铁与被还原的硝酸物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 堆积方式 | 晶胞棱长(cm) |
| Ⅰ | 面心立方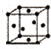 | a |
| Ⅱ | 体心立方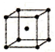 | b |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
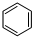 (g)+3H2(g)$\frac{\underline{\;\;\;\;\;\;\;\;\;高温\;\;\;\;\;\;\;\;\;}}{Fe_{3}O_{4}/Al_{2}O_{3}}$
(g)+3H2(g)$\frac{\underline{\;\;\;\;\;\;\;\;\;高温\;\;\;\;\;\;\;\;\;}}{Fe_{3}O_{4}/Al_{2}O_{3}}$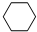 (g)
(g) 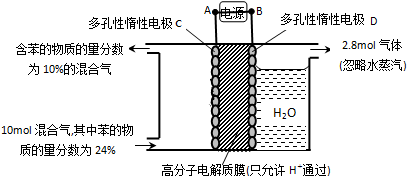
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2 | |
| B. | 生成物总能量均高于反应物总能量 | |
| C. | 生成1mol HCl(g)放出Q1热量 | |
| D. | 等物质的量时,Br2(g)具有的能量低于Br2(l) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取浸取液少许,滴入AgNO3溶液有白色沉淀产生,则可能含有Cl- | |
| B. | 取浸取液少许,加入Cu和浓H2SO4,试管口有红棕色气体产生,则可能含有NO3- | |
| C. | 取浸取液少许,滴入硝酸酸化的BaCl2溶液,有白色沉淀产生,则一定含SO42- | |
| D. | 用洁净的铂丝棒蘸取浸取液,在酒精灯外焰上灼烧,焰色呈黄色,则一定含有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 最外层电子数:Z>R>Y | |
| B. | 气态氢化物的稳定性:Y>Z | |
| C. | R、X的氧化物均为离子化合物 | |
| D. | X和Y两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com