
”¾ĢāÄæ”æij¹¤³§µÄ¹¤Ņµ·ĻĖ®ÖŠŗ¬ÓŠ“óĮæµÄFeSO4”¢½Ļ¶ąµÄCu2+ŗĶÉŁĮæµÄNa+ £® ĪŖĮĖ¼õÉŁĪŪČ¾²¢±ä·ĻĪŖ±¦£¬¹¤³§¼Ę»®“ÓøĆ·ĻĖ®ÖŠ»ŲŹÕĮņĖįŃĒĢśŗĶ½šŹōĶ£®Ēėøł¾ŻĮ÷³ĢĶ¼£¬ŌŚ·½æņŗĶĄØŗÅÄŚĢīŠ“ĪļÖŹĆū³Ę£Ø»ņÖ÷ŅŖ³É·ÖµÄ»ÆѧŹ½£©»ņ²Ł×÷·½·Ø£¬Ķź³É»ŲŹÕĮņĖįŃĒĢśŗĶĶµÄ¼ņµ„ŹµŃé·½°ø£® 
£Ø1£©²Ł×÷¢ŚµÄĆū³ĘĪŖ £¬ ĖłŠčŅŖµÄ²£Į§ŅĒĘ÷ĪŖ”¢”¢ÉÕ±£®
£Ø2£©ŹŌ¼Į¢ŻµÄ»ÆѧŹ½ĪŖ £¬ ·¢ÉśµÄ»Æѧ·½³ĢŹ½ĪŖ £®
£Ø3£©ĪŖŃéÖ¤ČÜŅŗ¢ąÖŠŗ¬ÓŠSO42©£ŗȔɣĮæµÄČÜŅŗ¢ąÓŚŹŌ¹ÜÖŠ£¬ĻČ¼ÓČėŌŁ¼ÓČė £¬ Čō¹Ū²ģµ½ÓŠ°×É«³Įµķ£¬ŌņĖµĆ÷ČÜŅŗ¢ąÖŠŗ¬ÓŠSO42© £®
”¾“š°ø”æ
£Ø1£©¹żĀĖ£»Ā©¶·£»²£Į§°ō
£Ø2£©H2SO4£»Fe+H2SO4=FeSO4+H2”ü
£Ø3£©×ćĮæĻ”ŃĪĖį£»ÉŁĮæBaCl2ČÜŅŗ
”¾½āĪö”æ½ā£ŗ¹¤Ņµ·ĻĖ®ÖŠŗ¬“óĮæĮņĖįŃĒĢś”¢Cu2+ŗĶÉŁĮæµÄNa+ £¬ “ÓøĆ·ĻĖ®ÖŠ»ŲŹÕĮņĖįŃĒĢśŗĶ½šŹōĶ£¬½įŗĻĮ÷³ĢæÉÖŖ£¬¢ŁĪŖFe£¬²Ł×÷¢ŚĪŖ¹żĀĖ£¬ŌņEÖŠÖ÷ŅŖŗ¬ĮņĖįŃĒĢś£¬¢ŪÖŠŗ¬Cu”¢Fe£¬¼ÓČė¢ŻĪŖH2SO4 £¬ ²Ł×÷¢ŽĪŖ¹żĀĖ£¬µĆµ½¢ßĪŖCu£¬¢ąÖŠÖ÷ŅŖŗ¬FeSO4 £¬ ²Ł×÷¢įĪŖÕō·¢”¢ÅØĖõ”¢½į¾§”¢¹żĀĖ£¬æɵƵ½FeSO4.7H2O£¬£Ø1£©²Ł×÷¢ŚµÄĆū³ĘĪŖ¹żĀĖ£¬ĖłŠčŅŖµÄ²£Į§ŅĒĘ÷ĪŖĀ©¶·”¢²£Į§°ō”¢ÉÕ±£¬ĖłŅŌ“š°øŹĒ£ŗ¹żĀĖ£»Ā©¶·£»²£Į§°ō£»£Ø2£©ŹŌ¼Į¢ŻµÄ»ÆѧŹ½ĪŖH2SO4 £¬ »Æѧ·½³ĢŹ½ĪŖFe+H2SO4=FeSO4+H2”ü£¬ĖłŅŌ“š°øŹĒ£ŗH2SO4£»Fe+H2SO4=FeSO4+H2”ü£»£Ø3£©ĻČ¼ÓČė×ćĮæĻ”ŃĪĖįŌŁ¼ÓČėÉŁĮæBaCl2ČÜŅŗ£¬Čō¹Ū²ģµ½ÓŠ°×É«³Įµķ£¬ŌņĖµĆ÷ČÜŅŗ¢ąÖŠŗ¬ÓŠSO42© £¬ ĖłŅŌ“š°øŹĒ£ŗ×ćĮæĻ”ŃĪĖį£»ÉŁĮæBaCl2ČÜŅŗ£®


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻņĻĀĮŠČÜŅŗÖŠ·Ö±š¼ÓČėĻõĖįŅųČÜŅŗŗĶĻ”ĻõĖį£¬²»ÄÜÉś³É°×É«³ĮµķµÄŹĒ
A. ĀČĖ® B. ĀČĖį¼Ų C. ĀČ»Æ¼Ų D. ŃĪĖį
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉś»īÖŠĶس£ÓĆ75%µÄ¾Ę¾«½ųŠŠĻū¶¾£¬¹ŲÓŚ¾Ę¾«µÄĆčŹöŗĶ¶ŌÓ¦ŠŌÖŹ²»Ę„ÅäµÄŹĒ
A.ÄÜĪŵ½¾Ę¾«µÄĘųĪ¶£ŗ»Ó·¢ŠŌ
B.ÓöĆ÷»š»ņøßĪĀ»įČ¼ÉÕ£ŗæÉČ¼ŠŌ
C.³żČ„ŅĀĪļÉĻµÄĪŪ×Õ£ŗČܽāŠŌ
D.ÓĆĶ“߻ƼÓČČÄÜÉś³ÉŅŅČ©£ŗĒæŃõ»ÆŠŌ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æMg-AgClµē³ŲŹĒŅ»ÖÖÄܱ»ŗ£Ė®¼¤»īµÄŅ»“ĪŠŌÖü±øµē³Ų£¬µē³Ų·“Ó¦·½³ĢŹ½£ŗ2AgCl+ Mg = Mg2++ 2Ag+2Cl-”£ÓŠ¹ŲøƵē³ŲµÄĖµ·ØÕżČ·µÄŹĒ£Ø £©
A. MgĪŖµē³ŲµÄÕż¼« B. øŗ¼«·“Ó¦ĪŖAgCl+e-=Ag+Cl-
C. ²»Äܱ»KClČÜŅŗ¼¤»ī D. æÉÓĆÓŚŗ£ÉĻÓ¦¼±ÕÕĆ÷¹©µē
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬Ļņ10 mL 0.1 mol”¤L£1µÄH2C2O4ČÜŅŗÖŠÖšµĪ¼ÓČė0.1 mol”¤L£1 KOHČÜŅŗ£¬ĖłµĆµĪ¶ØĒśĻßČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
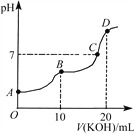
A. KHC2O4ČÜŅŗ³ŹČõ¼īŠŌ
B. BµćŹ±£ŗc(K£«)>c(HC2O4£)> c(C2O42£)>c(H£«)>c(OH£)
C. CµćŹ±£ŗc(K£«)>c(HC2O4£)£«c(C2O42£)£«c(H2C2O4)
D. DµćŹ±£ŗc(C2O42£)£«c(HC2O4£)£«c(H2C2O4)£½0.1 mol”¤L£1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.ĒāŌ×Ó¹āĘײ¢²»ŹĒĖłÓŠŌŖĖŲµÄ¹āĘ×ÖŠ×ī¼ņµ„µÄ
B.”°Įæ×ӻƔ±¾ĶŹĒ²»Į¬ŠųµÄŅāĖ¼£¬Ī¢¹ŪĮ£×ÓŌĖ¶Æ¾łÓŠ“ĖĢŲµć
C.²£¶ūĄķĀŪ²»µ«³É¹¦µŲ½āŹĶĮĖĒāŌ×Ó¹āĘ×£¬¶ųĒŅ»¹ĶĘ¹ćµ½ĘäĖūŌ×Ó¹āĘ×
D.Ō×ÓÖŠµē×ÓŌŚ¾ßÓŠČ·¶Ø°ė¾¶µÄŌ²ÖܹģµĄÉĻĻń»š³µŅ»ŃłøßĖŁŌĖ×Ŗ×Å
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬½«ŅŅĖįŗĶĒāŃõ»ÆÄĘČÜŅŗ»ģŗĻ£¬ĖłµĆČÜŅŗpH=7£¬Ōņ“ĖČÜŅŗÖŠ£Ø £©
A. c£ØCH3COO-£©£¾c£ØNa+£© B. c£ØCH3COO-£©£¼c£ØNa+£©
C. c£ØCH3COO-£©= c£ØNa+£© D. ĪŽ·ØČ·¶Ø c£ØCH3COO-£©Óėc£ØNa+£©µÄ¹ŲĻµ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĒė°“ŅŖĒóĢīæÕ”£
£Ø1£©AgNO3µÄĖ®ČÜŅŗ³Ź________£ØĢī”°Ėį”±”¢”°ÖŠ”±”¢”°¼ī”±£©ŠŌ£¬ŹµŃéŹŅŌŚÅäÖĘAgNO3µÄČÜŅŗŹ±£¬³£½«AgNO3¹ĢĢåĻČ____________________£¬Č»ŗóŌŁ_________________________£¬ŅŌŅÖÖĘĘäĖ®½ā”£
£Ø2£©Įņ»ÆÄĘČÜÓŚĖ®Ź±·¢ÉśĖ®½ā£¬ĘäĖ®½āµÄĄė×Ó·½³ĢŹ½ĪŖ_____________________________£¬ŌŚÅäÖĘĮņ»ÆÄĘČÜŅŗŹ±æÉŅŌ¼ÓČėÉŁĮæµÄ________________ŅŌŅÖÖĘĘäĖ®½ā”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪĀ¶ČĪŖ25”ꏱ£¬½«0.23 gÄĘĶ¶Čėµ½100gĖ®ÖŠ³ä·Ö·“Ó¦£¬¼ŁÉč·“Ó¦ŗóČÜŅŗĢå»żĪŖ100mL£¬ŌņøĆČÜŅŗµÄpHĪŖ
A. 1 B. 13 C. 12 D. 10
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com