
下列说法正确的是
A.若把H2S分子写成H3S分子,违背了共价键的饱和性
B.H3O+离子的存在,说明共价键不应有饱和性
C.所有共价键都有方向性
D.两个原子轨道发生重叠后,两核间的电子仅存在于两核之间
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、B、C、D是短周期的四种主族元素,它们的原子序数依次增大,四种元素中只有C是金属元素,A与C的最外层电子数相等,C、D两元素原子的电子数之和为A、B两种元素原子的电子数之和的3倍。试推断:
(1)写出A、B、C、D的元素符号:
A__________、B__________、C__________、D__________;
(2)写出D元素原子的基态电子排布式________________;
(3)B、C、D三元素的第一电离能由大到小的顺序为__________(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物分子中原子或原子团间的相互影响会导致化学性质的不同。下列叙述不能说明上述观点的是
A.苯酚能与NaOH溶液反应,而乙醇不能
B.丙酮(CH3COCH3)分子中的H比乙烷分子中的H更易被卤原子取代
C.乙烯可发生加成反应,而乙烷不能
D.苯酚能与浓溴水反应,而苯不可以
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足8电子稳定结构
B.P4和CH4都是正四面体形分子且键角都为109°28′
C.NH4+的电子式为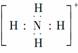 ,离子呈平面正方形结构
,离子呈平面正方形结构
D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等。巴特列为开拓稀有气体化学作出了历史性贡献。
①请根据XeF4的结构示意图(图1)判断这个分子是 (填极性分子或非极性分子)。
②XeF2晶体是一种无色晶体,图2为它的晶胞结构图。XeF2晶体属于哪种类型的晶体__________;
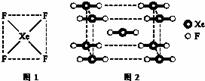
③一个XeF2晶胞中实际拥有XeF2_______个。
(2)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为 ,1 mol乙醛分子中含有的σ键的数目为 。乙酸的沸点明显高于乙醛,其主要原因是 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D与F为同一周期,A与D、C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温压下有三种是气体,三种是固体。
请回答下列问题:
(1) 工业上用A和B的单质化合制备化合物X,该反应的化学方程式
(2)若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: 。
(3)若D、E、F的最高价氧化物的水化物两两能发生反应,则E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式
(4)用电子式表示化合物D2F的形成过程 。
(5)由A、B、C三种元素组成的化合物X中共含有9个原子,X中所含化学键类型有
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)
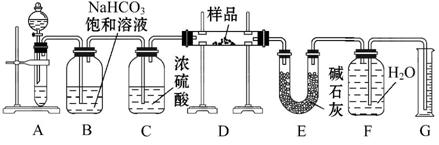
回答下列问题:
(1)装置A中液体试剂选用 ,理由是 ____________________________。
(2)装置B的作用是 _________________________________________________,
装置E中碱石灰的作用是 ____________________________________________。
(3)装置D中发生反应的化学方程式是 ________,_________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com