
【题目】在容积一定的密闭容器中,可逆反应:A2(g)+B2(g)![]() xC(g)符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是
xC(g)符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是

A.P3<P4,Y轴表示A2的转化率
B.P3>P4,Y轴表示A2的浓度
C.P3>P4,Y轴表示混合气体的密度
D.P3>P4,Y轴表示混合气体的平均摩尔质量
【答案】D
【解析】
由图Ⅰ可知,温度为T1时,根据到达平衡的时间可知P2>P1,且压强越大,C的含量越高,说明平衡向正反应方向移动,正反应为气体体积减小的反应;压强为P2时,根据到达平衡的时间可知T1>T2,且温度越高,C的含量越低,说明平衡向逆反应方向移动,则正反应为放热反应;
由图Ⅱ可知,y随温度的升高而降低,结合温度对平衡移动的影响判断y表示的物理量,结合压强对平衡移动的影响判断P3、P4的关系。
由图Ⅰ可知,温度为T1时,根据到达平衡的时间可知P2>P1,且压强越大,C的含量越高,说明平衡向正反应方向移动,正反应为气体体积减小的反应;压强为P2时,根据到达平衡的时间可知T1>T2,且温度越高,C的含量越低,说明平衡向逆反应方向移动,则正反应为放热反应;
A.P3<P4,在温度相同条件下,增大压强平衡向正反应移动,A2的转化率增大,同时升高温度平衡向逆反应移动,A2的转化率降低,图象与实际不符,故A错误;
B.P3>P4,在温度相同条件下,增大压强平衡向正反应移动,A2的浓度降低,同时升高温度平衡向逆反应移动,A2的浓度增大,图象与实际不符,故B错误;
C.P3>P4,在温度相同条件下,增大压强平衡向正反应移动,但混合气体的质量不变,容器的体积不变,密度不变。升高温度平衡向逆反应移动,但混合气体的质量不变,容器的体积不变,密度不变,图象与实际不相符,故C错误;
D.P3>P4,在相同温度下增大压强平衡向正反应方向移动,混合气体的总质量不变,总的物质的量减小,混合气的平均摩尔质量增大,升高温度,平衡向逆反应方向移动,混合气体总的物质的量增大,混合气的平均摩尔质量减小,图象与实际相符,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】分类法在化学物质及反应的学习中起着重要的作用。有以下物质:①液氯②磁性氧化铁③碱石灰④石油⑤氢氧化铁胶体⑥浓硫酸⑦黑火药⑧铜
(1)上述物质中属于混合物的是___________。
(2)石油可以通过分馏(多次蒸馏)得到煤油、汽油等产物,该变化属于___(填“物理变化”或“化学变化”)。
(3)简述浓硫酸稀释的操作_________________。
(4)氢氧化铁胶体和氢氧化铁沉淀的本质区别在于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa时,有以下能量转化图,下列说法不正确的是( )
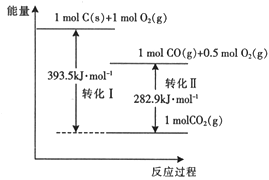
A. 转化Ⅱ的热化学方程式2CO(g)+O2(g)=2CO2(g) △H=-282.9 kJ·mol-1
B. 相同条件下,1mol C(s )和0.5 mol O2(g)总能量高于1mol CO(g)的能量
C. 由C→CO 的热化学方程式2C(s)+O2(g)=2CO(g) △H=-221.2 kJ·mol-1
D. CO2(g)分解为C(s)和O2(g)是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的HR溶液中逐滴加入0.1mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )
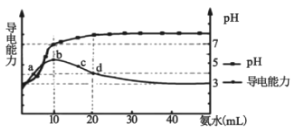
A.溶液中的阳离子浓度总和最大的是d点
B.常温下,HR的电离平衡常数数量级为10-8
C.b点和d点溶液中,水的电离程度不相等
D.d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2SO3是一种白色粉末,工业上可用作还原剂、防腐剂等。某化学小组探究不同pH的Na2SO3溶液与同浓度AgNO3溶液反应的产物,进行如下实验。
I.(1)配制500mL一定浓度的Na2SO3溶液
①溶解:准确称取一定质量的Na2SO3晶体,用煮沸的蒸馏水溶解。蒸馏水需煮沸的原因是___。
②移液:将上述溶解后的Na2SO3溶液在烧杯中冷却后转入仪器A中,则仪器A为_,同时洗涤___(填仪器名称)2~3次,将洗涤液一并转入仪器A中;
③定容:加水至刻度线1~2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。
Ⅱ.探究不同pH的Na2SO3溶液与pH=4的AgNO3溶液反应的产物
查阅资料:i.Ag2SO3为白色固体,不溶于水,溶于过量Na2SO3溶液
ii.Ag2O,棕黑色固体,不溶于水,可与浓氨水反应
(2)将pH=8的Na2SO3溶液滴人pH=4的AgNO3溶液中,至产生白色沉淀。
假设一:该白色沉淀为Ag2SO3
假设二:该白色沉淀为Ag2SO4
假设三:该白色沉淀为Ag2SO3和Ag2SO4的混合物
①写出假设一的离子方程式__;
②提出假设二的可能依据是___;
③验证假设三是否成立的实验操作是__。
(3)将pH=4的AgNO3溶液逐滴滴人足量的pH=11的Na2SO3溶液中,开始产生白色沉淀A,然后变成棕黑色物质。为了研究白色固体A的成分,取棕黑色固体进行如下实验:

①已知反应(b)的化学方程式为Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O,则反应(a)的化学方程式为___;
②生成白色沉淀A的反应为非氧化还原反应,则A的主要成分是__(写化学式)。
(4)由上述实验可知,盐溶液间的反应存在多样性。经验证,(2)中实验假设一成立,则(3)中实验的产物不同于(2)实验的条件是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种新型离子化合物,该物质由两种阳离子和两种阴离子构成,其中有一种 18 电子离子和两种 10 电子离子。W、X、Y、Z 均为短周期元素,且均不在同一主族。下列说法不正确的是
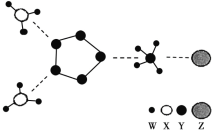
A.X 与 W 形成的化合物沸点高于 X 同族元素与 W 形成的化合物
B.Z 的最高价氧化物对应水化物的酸性比 Y 的强
C.Y 气态氢化物的稳定性比 X 的强
D.如图化合物中,存在极性共价键和非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A(g)![]() 2B(g) H>0,在温度为T1和T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。
2B(g) H>0,在温度为T1和T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。

(1)根据曲线图,下列说法不正确的是___。
A.a、c两点的反应速率:c>a
B.b、c两点A气体的转化率相等
C.由状态b到状态a,可以通过加热的方法
D.由状态b到状态c,可以通过加压的方法
(2)若上述反应在定容密闭容器中进行,达到平衡状态的标志是___。
A.单位时间内生成nmolA的同时分解2nmolB B.两种气体的体积分数不再改变
C.混合气体的密度不再发生变化 D.混合气体的质量不再发生变化
(3)若上述反应达平衡时,B气体的平衡浓度为0.1mol·L-1,通过减小体积来增大体系的压强(温度保持不变),重新达平衡后,B气体的平衡浓度___0.1mol·L-1(填“大于”、“小于”或“等于”)。
(4)在100℃时,将0.40mol的B气体充入2L密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如表的数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(B)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(A)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
上表中n3___n4(填“大于”、“小于”或“等于”),反应A(g)![]() 2B(g)在100℃时的平衡常数K的值为___,升高温度后,反应2B(g)
2B(g)在100℃时的平衡常数K的值为___,升高温度后,反应2B(g)![]() A(g)的平衡常数K的值___(填“增大”、“减小”或“不变”)。
A(g)的平衡常数K的值___(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验兴趣小组设计如下微型实验装置,a、b为直流电源的两极。实验时,若断开K1,闭合K2,两极均有气泡产生,下列有关描述正确的是( )
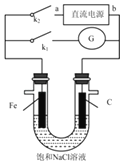
A.断开K1闭合K2时,总反应的离子方程式为:2H++2Cl﹣![]() H2↑+Cl2↑
H2↑+Cl2↑
B.断开K1闭合K2时,电子沿“a→Fe→电解质溶液→C→b”的路径流动
C.断开K2闭合K1时,此时发生的反应类似铁的吸氧腐蚀
D.断开K2闭合K1时,Fe电极被保护,此法称为牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置分别进行下列实验:将①中溶液滴入②中,按要求填写下列空格:

方案 | ①中物质 | ②中物质 | 填空编号及要求 |
实验1 | 滴加过酚酞的水 | Na2O2 | 写出会看到的现象①_____ |
实验2 | NaOH溶液 | 未打磨过的铝条 | 写出所发生反应的离子方程式 ②_____ |
实验3 | 盐酸 | NaAlO2溶液 | 画出生成沉淀量随盐酸的加入的变化图象 ③_____ |
实验4 | 稀盐酸 | Na2CO3与NaOH的混合溶液 | 已知生成气体量随盐酸的加入的变化图象如下,则原溶液中的Na2CO3与NaOH的物质的量浓度之比为 ④_____
|
实验5 | FeCl3和盐酸的混合液 | 等质量的铜、锌、铁三种金属的混合物 | 若反应后无固体剩余,则反应后的溶液中一定存在的阳离子是 ⑤_____ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com