
| A. | P是氧化剂 | B. | 氧化性H2O2>Na2H2P2O6 | ||
| C. | 1mol H2O2反应,转移电子1mol | D. | Na2H2P2O6中磷元素的化合价为+3 |
分析 反应2P+4H2O2+2NaOH═Na2H2P2O6+4H2O中,磷元素由0价变成+4价,是还原剂,过氧化氢是氧化剂,1mol H2O2反应,转移电子2mol,结合氧化剂的氧化性强于氧化产物的氧化性分析判断.
解答 解:A、磷元素由0价变成+4价,是还原剂,故A错误;
B、过氧化氢是氧化剂,而Na2H2P2O6是氧化产物,所以氧化性H2O2>Na2H2P2O6,故B正确;
C、1mol H2O2反应,转移电子2mol,故C错误;
D、Na2H2P2O6中磷元素的化合价为+4,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子数的考查,注意从化合价分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
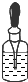 | 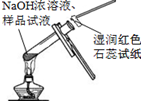 | 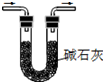 | 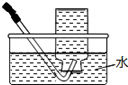 |
| A.将NaOH溶液存 放在玻璃瓶中 | B.检验试液中NH4+ 的存在 | C.干燥CO2气体 | D.收集NH3气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,4.48 L水中含有的分子数目为0.2NA | |
| B. | 1 mol•L-1 的CaCl2溶液中,含有氯离子数2NA | |
| C. | 23g Na与足量O2反应转移的电子数为NA | |
| D. | 1mol苯中含有“C=C”的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
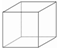 ,其六氯代物有3种;
,其六氯代物有3种;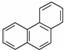 ,其二氯代物的数目为25种;
,其二氯代物的数目为25种;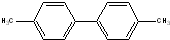 ),其二氯代物有16种.
),其二氯代物有16种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水吸收足量的SO2气体:2OH-+SO2═SO32-+H2O | |
| B. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3↓+OH- | |
| C. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3═N2↑+3Cl-+3H2O | |
| D. | NaHCO3溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
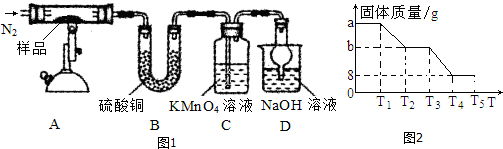
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com