
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
分析 (1)加入的物质用于调节pH以除去杂质,主要将铁离子转化为氢氧化铁沉淀,且不能引入新杂质,先根据溶液的pH计算氢离子浓度,再结合水的离子积常数计算氢氧根离子浓度,最后根据c(Fe3+)=$\frac{Kw[Fe(OH){\;}_{3}]}{C{\;}^{3}(OH{\;}^{-})}$计算c(Fe3+);
(2)加热时促进氯化铜的水解且生成的氯化氢易挥发造成水解完全,要想得到较纯的无水氯化铜应在氯化氢气流中抑制其水解;
(3)依据碘化钾和氯化铜发生氧化还原反应,生成碘化亚铜沉淀,和碘单质,碘单质遇淀粉变蓝,依据碘单质被Na2S2O3标准溶液滴定到终点,发生反应离子方程式计算分析.
解答 解:(1)为得到纯净的CuCl2•2H2O晶体要除去氯化铁,则溶液中的Fe3+转化为Fe(OH)3沉淀,加入物质能与酸反应能转化为氯化铜,所以应该加入含铜元素和氢氧根离子的物质,可以是氢氧化铜或碱式碳酸铜;溶液的pH=4,所以溶液中氢离子浓度为10-4 mol/L,则氢氧根离子浓度为10-10 mol/L,c(Fe3+)=$\frac{Kw[Fe(OH){\;}_{3}]}{C{\;}^{3}(OH{\;}^{-})}$=$\frac{2.6×10{\;}^{-39}}{(1×10{\;}^{-10}){\;}^{3}}$=2.6×10-9mol/L,
故答案为:Cu(OH)2或Cu2(OH)2CO3 ;2.6×10-9mol/L;
(2)由于CuCl2在加热过程中水解被促进,且生成的HCl又易挥发而脱离体系,造成水解完全,碱式氯化铜或氢氧化铜,以至于得到CuO固体,而不是CuCl2,要想得到较纯的无水氯化铜应在氯化氢气流中抑制其水解,
故答案为:在干燥的HCl气流中加热脱水;
(3)测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL;反应的化学方程式为:2Na2S2O3+I2═Na2S4O6+2NaI,
①硫代硫酸钠滴定碘单质,利用碘单质遇淀粉变蓝选择指示剂为淀粉;终点为蓝色褪去,溶液中30s内不恢复原色,
故答案为:淀粉溶液;蓝色褪去,溶液中30s内不恢复原色;
②CuCl2溶液与KI反应的离子方程式为为:2Cu2++4I-=2CuI↓+I2,
故答案为:2Cu2++4I-=2CuI↓+I2;
③依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-=2CuI↓+I2;
得到 2Na2S2O3 ~2Cu2+
2 2
0.1000mol/L×0.0200L 0.002mol
则CuCl2•2H2O的物质的量为:0.002mol,
试样中CuCl2•2H2O的质量百分数为:$\frac{0.002mol×171g/mol}{0.36g}$×100%=95%,
故答案为:95%.
点评 本题考查Ksp计算和物质制备,为高频考点,侧重于学生的分析能力、实验能力和计算能力,题目涉及利用平衡移动原理、氧化还原滴定分析解答,明确滴定过程的反应原理和计算方法是解本题的关键,注意加热灼烧CuCl2溶液和CuSO4溶液得到固体的区别,为易错点,题目难度中等.


科目:高中化学 来源: 题型:实验题
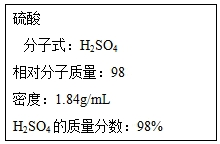 根据要求回答下列问题:
根据要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
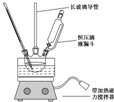 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: +HNO3(浓)$\frac{50~60℃}{98%浓{H}_{2}S{O}_{4}}$+
+HNO3(浓)$\frac{50~60℃}{98%浓{H}_{2}S{O}_{4}}$+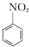 +H2O
+H2O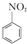 +HNO3(浓)$\frac{95%}{98%浓{H}_{2}S{O}_{4}}$
+HNO3(浓)$\frac{95%}{98%浓{H}_{2}S{O}_{4}}$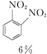 +
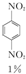
+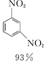 +
+
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
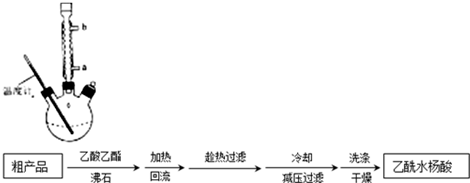
 用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物.(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出.请回答下列问题:
用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物.(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出.请回答下列问题:| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
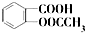 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.
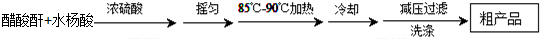
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 电离常数 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

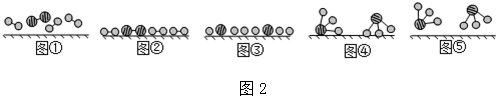
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com