
| A. | Na2CO3 NaCl NaOH | B. | NaOH NaCl Na2CO3 | ||
| C. | NaCl NaOH Na2CO3 | D. | NaCl Na2CO3 NaOH |
分析 使Ag+生成沉淀,应加入NaCl,使Mg2+生成沉淀应加入NaOH,使Ba2+生成沉淀应加入Na2CO3,如先加入Na2CO3,会使Mg2+、Ag+、Ba2+三都生成沉淀,先加入NaOH会使Mg2+、Ag+生成沉淀,则应先加入NaCl,再加入NaOH,最后加入Na2CO3.
解答 解:A.由于碳酸钠溶液中的碳酸根离子能与溶液中Mg2+、Ag+、Ba2+均形成沉淀,先加入碳酸钠溶液会出现三种沉淀,不符合每次得到一种沉淀的要求,故A错误;
B.由于氢氧化钠溶液中的氢氧根离子能与溶液中的Mg2+、Ag+形成沉淀,先加入氢氧化钠溶液出现象两种沉淀,不符合每次得到一种沉淀的要求,故B错误;
C.氯化钠只能与溶液中Ag+形成氯化银沉淀,然后加入的氢氧化钠只与溶液中Mg2+形成氢氧化镁沉淀,最后加入的碳酸钠沉淀溶液中的Ba2+形成碳酸钡沉淀,满足每次只得一种沉淀的要求,故C正确;
D.氯化钠溶液沉淀溶液中Ag+后,加入的碳酸钠溶液却能同时沉淀溶液中Mg2+、Ba2+的,不符合每次得到一种沉淀的要求,故D错误;
故选C.
点评 本题考查物质的分离操作,注意每次只加一种溶液、滤出一种沉淀的要求,需要考虑每次所加入的试剂只能与溶液中的一种离子形成沉淀,因此,在分析所加入试剂时要全面考虑该试剂与溶液中的离子发生反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 单质硅是将太阳能转化为电能的常用材料 | |
| B. | 大气中SO2是形成酸雨的主要因素之一 | |
| C. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 | |
| D. | “血液透析”利用了胶体的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金都只是由两种或多种金属熔合而成的 | |
| B. | 青铜、黄铜、白铜都是合金 | |
| C. | 合金属于纯净物 | |
| D. | 钢不属于合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下干燥的Cl2能用钢瓶贮运 | |
| B. | 检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液 | |
| C. | 自然界中不存在游离态硅 | |
| D. | HF溶液不能贮存在磨口玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Cl-、Na+、NO3- | B. | Na+、Ba2+、Cl-、NO3- | ||
| C. | K+、Na+、NO3-、HCO3- | D. | Na+、K+、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y | |
| B. | 元素W最高价氧化物的水化物为强酸 | |
| C. | 化合物X2Y、Z2Y中化学键的类型相同 | |
| D. | 元素Y的简单气态氢化物的热稳定性比W的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
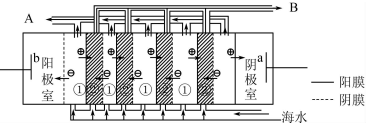
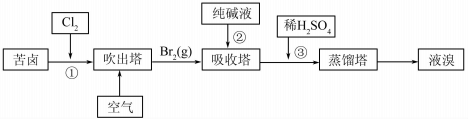
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++CO32- | |
| B. | 过量的CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O═HCO3-+HClO | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+═CO2↑+H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
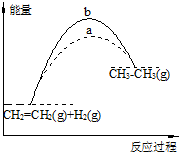
| A. | 图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 | |
| B. | 己知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2 则△H1>△H2 | |
| C. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | 在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com