
(18分)钛被誉为“二十一世纪的金属”,用途广泛。按下图所示组成的产业链可以大大提高资源利用率并能减少环境污染。请回答下列问题:
(1)已知中FeTiO3元素的化合价为+3,钛铁矿经氯化法得到四氯化钛的过程中________元素被氧化,每生产1. 9kgTiCl4消耗Cl2在标准状况下的体积为________L。
则金属Mg还原TiCl4制取金属Ti (s)的热化学方程式为___________.
(3)某化学兴趣小组探究外界条件对合成甲醇反应的影响。
①在300℃时,向体积为1L的密闭容器中加入2mol H2和1mol CO,CO和CH3OH(g)的浓度随时间变化如图所示。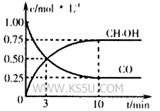
则从反应开始到建立平衡,v(H2)为___________ ;
该温度下 的化学平衡常
的化学平衡常
数为___________ 。
。
②在其它条件不变,只改变其中的一个条件,该小组同学
根据实验绘制如下图像,其中与事实相符的是为___________(填
序号)。
(4)电解饱和食盐水是氯碱工业的基础。
①电解饱和食盐水的离子方程式为为___________ 。
②电解时用盐酸控制阳极区溶液的pH在2~3,盐酸的作用为为___________。(用必要的离子方程式和文字说明)
(18分)
(1)Ti、C(2分),784(3分)
(2)2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s) ?H=-478kJ?mol?1(2分)
(3)①0.15mo?L-1?min-1(2分) 12(2分)
②AD(3分)(缺1项扣1分,有错误选项不给分)
(4)①2Cl?+2H2O  H2↑+Cl2↑+2OH?(2分)
H2↑+Cl2↑+2OH?(2分)
②Cl2与H2O反应:Cl2+H2O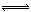 H++Cl?+HClO,增大H+浓度使平衡逆向移动,减少Cl2在水中的溶解,有利于Cl2逸出。(2分)
H++Cl?+HClO,增大H+浓度使平衡逆向移动,减少Cl2在水中的溶解,有利于Cl2逸出。(2分)
解析试题分析:(1)根据流程图可知FeTiO3、C、Cl2反应生成FeCl3、TiCl4、CO,化合价升高的元素为Ti和C,所以Ti和C元素被氧化;1. 9kgTiCl4消物质的量为:1900g÷190g/mol=10mol,根据FeTiO3可知生成的FeCl3和TiCl4物质的量相等,都是10mol,根据Cl元素守恒Cl2的物质的量为(30mol+40mol)÷2=35mol,所以消耗Cl2在标准状况下的体积为:35mol×22.4L/mol=784L。
(2)首先写出金属Mg还原TiCl4制取金属Ti (s)的化学方程式,并注明状态:2Mg(s)+TiCl4(g)=2MgCl2(s)+
Ti(s),然后根据盖斯定律求焓变,?H=2?H1—?H2=-478kJ?mol?1,可得热化学方程式。
(3)①v(H2)=v(CH3OH)=2×0.75mol/L÷10min=0.15mo?L-1?min-1;根据三段式进行计算:
CO(g) + 2H2(g) 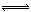 CH3OH(g)
CH3OH(g)
起始浓度(mol?L?1) 1 2 0
转化浓度(mol?L?1) 0.75 1.5 0.75
平衡浓度(mol?L?1) 0.25 0.5 0.75
则化学平衡常数为:0.75mol/L÷[0.25mol/L×(0.5mol/L )2] =12(mol?L?1)-2
② A、CO与H2生成CH3OH的反应为放热反应,350℃大于300℃,反应速率加快,平衡向逆反应方向移动,甲醇的物质的量减小,正确;B、该反应正反应方向气体系数减小,所以增大压强平衡向右移动,甲醇的物质的量增大,图像错误;C、该反应为放热反应,350℃大于300℃,反应速率加快,平衡向逆反应方向移动,甲醇的物质的量减小,图像错误;D、催化剂能加快反应速率,但不影响化学平衡,图像正确。
(4)①电解饱和食盐水生成H2、Cl2、NaOH,离子方程式为:2Cl?+2H2O  H2↑+Cl2↑+2OH?
H2↑+Cl2↑+2OH?
②因为阳极生成Cl2,Cl2能溶于H2O且与水反应:Cl2+H2O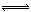 H++Cl?+HClO,加入盐酸控制阳极区溶液的pH在2~3,增大H+浓度使平衡逆向移动,减少Cl2在水中的溶解,有利于Cl2逸出。
H++Cl?+HClO,加入盐酸控制阳极区溶液的pH在2~3,增大H+浓度使平衡逆向移动,减少Cl2在水中的溶解,有利于Cl2逸出。
考点:本题考查热化学方程式书写、化学反应速率与化学平衡、电解原理、化学计算。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:填空题
一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g)  Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
| 反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
| c(X)/(mol·L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(16分)Ⅰ.硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下: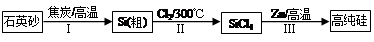
(1)焦炭在过程Ⅰ中做 剂。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的化学方程式为 。
(3)整过生产过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应方程式为 。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是 。
(4)Zn还原SiCl4的反应如下:
反应①:400℃~756℃,SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(l) △H1<0
Si(S)+2ZnCl2(l) △H1<0
反应②:756℃~907℃,SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(g) △H2<0
Si(S)+2ZnCl2(g) △H2<0
反应③:907℃~1410℃,SiCl4(g)+2Zn(g) Si(S)+2ZnCl2(g) △H3<0
Si(S)+2ZnCl2(g) △H3<0
i. 反应②的平衡常数表达式为 。
ii. 对于上述三个反应,下列说明合理的是 。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应速率 d.Na、Mg可以代替Zn还原SiCl4
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,可用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化成H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程 。
Ⅱ.(1)甲烷、氢气、一氧化碳的燃烧热分别为akJ·mol-1,bkJ·mol-1,ckJ·mol-1,工业上利用天燃气和二氧化碳反应制备合成气(CO、H2),其热化学反应方程式为 。
(2)已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,三种难溶盐的饱和溶液中,Ag+浓度大小的顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(16分)高铁酸钠(Na2FeO4)具有很强的氧化性,广泛应用于净水、电池工业等领域。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下,回答下列问题: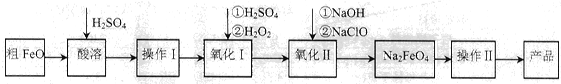
已知:NaClO不稳定,受热易分解。
(1)粗FeO酸溶过程中通入水蒸气(高温),其目的是__________________________。
(2)操作I目的是得到高纯度FeSO4溶液,则氧化I中反应的离子方程式为_________。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备
①Cl2与NaOH溶液反应的离子方程式为_________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/℃ | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:问答题
含硫化合物在工业生产中有广泛的用途。
(1)SO2可用于工业生产SO3。
①在一定条件下,每生成8g SO3气体,放热9.83kJ。该反应的热化学方程式为________。
②在500℃,催化剂存在的条件下,向容积为1L的甲、乙两个密闭容器中均充入 2 mol SO2和1 mol O2。甲保持压强不变,乙保持容积不变,充分反应后均达到平衡。
I.平衡时,两容器中SO3体积分数的关系为:甲_______乙(填“>”、“<”或“ =”)。
II.若乙在t1 min时达到平衡,此时测得容器乙中SO2的转化率为90%,则该
反应的平衡常数为_______;保持温度不变,t2 min时再向该容器中充入1 mol SO2和1 mol SO3,t3min时达到新平衡。请在下图中画出t2~t4 min内正逆反应速率的变化曲线(曲线上必须标明V正、V逆 )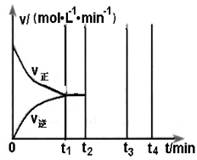
(2)硫酸镁晶体(MgSO4·7H2O )在制革、医药等领域均有广泛用途。4.92g硫酸镁晶体受热脱水过程的热重曲线(固体质量随温度变化的曲线)如右图所示。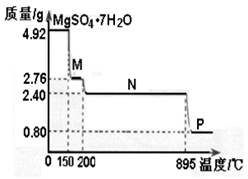
①固体M的化学式为__________。
②硫酸镁晶体受热失去结晶水的过程分为_________个阶段。
③N转化成P时,同时生成另一种氧化物,该反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(6分)把6 molA气体和5 molB气体混合放入4L恒容密闭容器中。在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
求:(1)平衡时A的物质的量浓度; (2) B的转化率;(3) x的值。(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
硫酸工业在国民经济中占有极其重要的地位。请回答硫酸工业中的如下问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 郊
区(填标号);
| A.有丰富黄铁矿资源的城市 | B.风光秀丽的旅游城市 |
| C.消耗硫酸甚多的工业城市 | D.人口稠密的文化、商业中心城市 |
 SO3 △H <0,现将0.050mol SO2和0.030mol O2
SO3 △H <0,现将0.050mol SO2和0.030mol O2| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g)=n Z(g)+6 W(g)。2 min 末测得容器内的压强变为原来压强的1.05倍,且测知前2min内以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。
求:(1)前2 min内用X的浓度变化表示的平均反应速率?
(2)2min末Y的浓度?
(3)化学反应方程式中n的值?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com