

硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒,存在于多种生产过程以及自然界中。在人体的很多生理过程中也起着重要作用。
资料:①H2S可溶于水?约1∶2?,其水溶液为二元弱酸。
②H2S可与许多金属离子反应生成沉淀。
③H2S在空气中燃烧,火焰呈淡蓝色。
(1)某化学小组设计了制取H2S并验证其性质的实验,如下图所示。A中是CuSO4溶液,B中放有湿润的蓝色石蕊试纸,C中是FeCl3溶液。
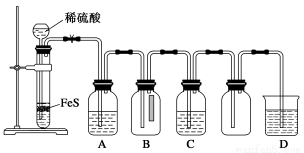
回答下列问题:
①A中有黑色沉淀(CuS)产生,A中发生反应的化学方程式为___________________。
②B中的现象是__________________。
③C中只有浅黄色沉淀产生,且溶液变浅绿色。则C中发生反应的离子方程式为______________。
④D中盛放的试剂可以是________(填字母序号)。
a.水 b.盐酸
c.NaCl溶液 d.NaOH溶液
(2)为进一步探究-2价硫的化合物与+4价硫的化合物反应条件,小明同学又设计了下列实验。
| 实验操作 | 实验现象 |
实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合 | 无明显现象 |
实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
已知:电离平衡常数:
H2S Kal=1.3×10-7,Ka2=7.1×10-15
H2SO3 Ka1=1.7×10-2,Ka2=5.6×10-8
①根据上述实验,可以得出结论:在__________条件下,+4价硫化合物可以氧化-2价硫的化合物。
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是________(填字母序号)。

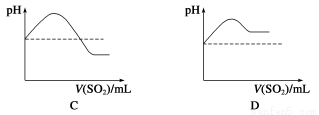
(3)文献记载,常温下H2S可与Ag发生置换反应生成H2。现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应______。
(1)①H2S+CuSO4=CuS↓+H2SO4②蓝色石蕊试纸变红
③H2S+2Fe3+=S↓+2H++2Fe2+ ④d
(2)①酸性(或酸性较强)②C
(3)将反应后的气体通入足量氢氧化钠溶液中(或硫酸铜溶液或氯化铁溶液等),除去未反应的H2S后,点燃,若观察到火焰呈淡蓝色,说明有H2生成,从而证明H2S与Ag发生了置换反应(或做爆鸣实验,其它合理答案均可)
【解析】(1)根据装置图,实验流程为
FeS+H2SO4=FeSO4+H2S↑
H2S+CuSO4=CuS↓+H2SO4
H2S H++HS-,显酸性,能使蓝色石蕊试纸变红。
H++HS-,显酸性,能使蓝色石蕊试纸变红。
2Fe3++H2S=S↓+2H++2Fe2+
D装置用于尾气处理,应选用NaOH溶液。
(2)①SO32—和S2-需在酸性条件下才能发生反应生成S。
②SO2+2H2S=3S↓+2H2O
SO2+H2O??H2SO3
H2SO3的酸性大于H2S,所以pH由小到大(接近7)再到小,且小于原氢硫酸的pH值,C项正确。
(3)H2S+2Ag=Ag2S+H2,应设计实验验证是否有H2生成。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:选择题
下列物质的转化在给定条件下不能实现的是( )

A.①②③ B.②③④ C.②③⑤ D.①④⑤
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十电解质溶液练习卷(解析版) 题型:选择题
一定温度下,水存在H2O H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是( )
H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是( )
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7 mol·L-1,Kw不变
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十六物质结构与性质练习卷(解析版) 题型:填空题
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素。A与B,C、D与E分别位于同一周期。A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式__________;F离子电子排布式为__________。
(2)写出X的化学式__________________________,化学名称为_________________。
(3)写出X涉及金属冶炼中的一个化学方程式_______________________________。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:
________________________________________________________________________。
(5)CE、FA的晶格能分别为786 kJ·mol-1、3 401 kJ·mol-1,试分析导致两者晶格能差异的主要原因是_______________________________________
(6)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________________(只要求列出算式)。
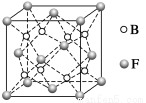
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十五综合实验探究练习卷(解析版) 题型:填空题
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
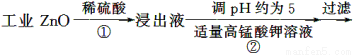
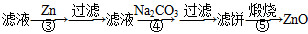
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1)反应②中除掉的杂质离子是__________,发生反应的离子方程式为__________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________________。
(2)反应③的反应类型为____________,过滤得到的滤渣中,除了过量的锌外还有______________。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是________________。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2,取干燥后的滤饼11.2 g,煅烧后可得到产品8.1 g,则x等于__________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十二常见非金属元素练习卷(解析版) 题型:选择题
“神九”飞船上载有活性炭材料的器材,其作用是( )
A.处理宇航员的生活垃圾 B.去除呼吸废气中的异味
C.提供生活中需要的能量 D.改善失重条件下的平衡
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:填空题
A、B、C、D、E是中学阶段常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的转化关系如图所示:
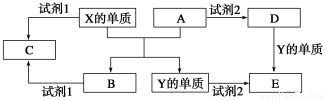
(1)X的单质与A反应的化学方程式是_______________________________。
(2)若试剂1是NaOH溶液,则X的单质与试剂1反应的离子方程式是
___________________________________
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是___________________________________。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)
________________________________________________。
③某高效净水剂是由Y(OH)SO4聚合得到的,工业上以E、稀硫酸和亚硝酸钠为原料制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是_____________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题五离子反应练习卷(解析版) 题型:填空题
有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液进行如下实验:
实验步骤 | 实验现象 |
①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
②取少量该溶液,加入铜片和浓硫酸,加热 | 有无色气体产生,遇空气可以变成红棕色 |
③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
④取③中的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断:
(1)溶液中一定存在的离子是______________;溶液中肯定不存在的离子是________________________。
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称(若为溶液反应,说明使用试剂的名称,不必写详细步骤)________________________________________。
(3)写出实验⑤中所有反应的离子方程式:______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com