
 £Ø1£©2mol O3ŗĶ 3mol O2µÄÖŹĮæÖ®±ČĪŖ1£ŗ1£¬·Ö×ÓŹżÖ®±ČĪŖ2£ŗ3£¬Ķ¬ĪĀĶ¬Ń¹ĻĀµÄĆܶČÖ®±ČĪŖ3£ŗ2£¬ŗ¬ŃõŌ×ÓŹżÖ®±Č1£ŗ1£¬Ģå»żÖ®±ČĪŖ2£ŗ3£®
£Ø1£©2mol O3ŗĶ 3mol O2µÄÖŹĮæÖ®±ČĪŖ1£ŗ1£¬·Ö×ÓŹżÖ®±ČĪŖ2£ŗ3£¬Ķ¬ĪĀĶ¬Ń¹ĻĀµÄĆܶČÖ®±ČĪŖ3£ŗ2£¬ŗ¬ŃõŌ×ÓŹżÖ®±Č1£ŗ1£¬Ģå»żÖ®±ČĪŖ2£ŗ3£®·ÖĪö £Ø1£©øł¾Żm=nM¼ĘĖćÖŹĮæÖ®±Č£¬·Ö×ÓŹżÄæÖ®±ČµČÓŚĘäĪļÖŹµÄĮæÖ®±Č£¬Ķ¬ĪĀĶ¬Ń¹ĻĀĘųĢåĆܶČÖ®±ČµČÓŚĘäĻą¶Ō·Ö×ÓÖŹĮæÖ®±Č£¬½įŗĻ·Ö×ÓŹ½¼ĘĖćŃõŌ×ÓŹżÄæÖ®±Č£¬Ķ¬ĪĀĶ¬Ń¹ĻĀĘųĢåĢå»żÖ®±ČµČÓŚĪļÖŹµÄĮæÖ®±Č£»
£Ø2£©øł¾Żn=$\frac{V}{{V}_{m}}$¼ĘĖć»ģŗĻĘųĢå×ÜĪļÖŹµÄĮ棬ŌŁ½įŗĻ×ÜÖŹĮæĮŠ·½³Ģ¼ĘĖćø÷×ŌĪļÖŹµÄĮ棬øł¾Ż$\overline{M}$=$\frac{{m}_{×Ü}}{{n}_{×Ü}}$¼ĘĖćĘ½¾łĻą¶Ō·Ö×ÓÖŹĮ棻
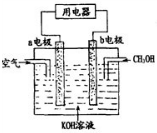
£Ø3£©ŅŃÖŖ£ŗ£Øi£©CH4£Øg£©+CO2£Øg£©?2CO£Øg£©+2H2£Øg£©”÷H1=+247.3kJ•mol-1
£Øii£©CO£Øg£©+2H2£Øg£©?CH3OH£Øg£©”÷H2=-90.1kJ•mol-1
£Øiii£©2CO£Øg£©+O2£Øg£©?2CO2£Øg£© £©”÷H3=-566.0kJ•mol-1
øł¾ŻøĒĖ¹¶ØĀÉ£¬i”Į2+2”Įii+iiiæÉµĆ£ŗ2CH4£Øg£©+O2£Øg£©?2CH3OH£Øg£©£»
£Ø4£©¢ŁŌµē³Ųøŗ¼«·¢ÉśŃõ»Æ·“Ó¦£¬¼×“¼ŌŚøŗ¼«Ź§Č„µē×Ó£¬¼īŠŌĢõ¼žĻĀÉś³ÉĢ¼ĖįøłĄė×ÓÓėĖ®£»
¢Ś·“Ó¦±¾ÖŹŹĒ¼×“¼Č¼ÉÕÉś³É¶žŃõ»ÆĢ¼ÓėĖ®£¬¶žŃõ»ÆĢ¼ÓėKOH·“Ӧɜ³ÉĢ¼Ėį¼ŲÓėĖ®£¬·“Ó¦ĻūŗÄKOH£¬µē½āÖŹČÜŅŗ¼īŠŌ¼õČõ£®
½ā“š ½ā£ŗ£Ø1£©2mol O3ŗĶ 3mol O2µÄÖŹĮæÖ®±ČĪŖ2mol”Į48g/mol£ŗ3mol”Į32g/mol=1£ŗ1£¬·Ö×ÓŹżÖ®±ČĪŖ2mol£ŗ3mol=2£ŗ3£¬Ķ¬ĪĀĶ¬Ń¹ĻĀµÄĆܶČÖ®±ČĪŖ48£ŗ32=3£ŗ2£¬ŗ¬ŃõŌ×ÓŹżÖ®±Č2mol”Į3£ŗ3mol”Į2=1£ŗ1£¬Ģå»żÖ®±ČĪŖ2mol£ŗ3mol=2£ŗ3£¬
¹Ź“š°øĪŖ£ŗ1£ŗ1£»2£ŗ3£»3£ŗ2£»1£ŗ1£»2£ŗ3£»
£Ø2£©»ģŗĻĘųĢå×ÜĪļÖŹµÄĮæĪŖ$\frac{6.72L}{22.4L/mol}$=0.3mol£¬
ÉčCOŗĶCO2µÄĪļÖŹµÄĮæ·Ö±šĪŖxmol”¢ymol£¬Ōņ£ŗ
$\left\{\begin{array}{l}{x+y=0.3}\\{28x+44y=11.6}\end{array}\right.$
½āµĆx=0.1”¢y=0.2
»ģŗĻĘųĢåĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæĪŖ$\frac{11.6}{0.3}$=38.7£¬
¹Ź“š°øĪŖ£ŗ0.1mol£»38.7£»
£Ø3£©ŅŃÖŖ£ŗ£Øi£©CH4£Øg£©+CO2£Øg£©?2CO£Øg£©+2H2£Øg£©”÷H1=+247.3kJ•mol-1
£Øii£©CO£Øg£©+2H2£Øg£©?CH3OH£Øg£©”÷H2=-90.1kJ•mol-1
£Øiii£©2CO£Øg£©+O2£Øg£©?2CO2£Øg£© £©”÷H3=-566.0kJ•mol-1
øł¾ŻøĒĖ¹¶ØĀÉ£¬i”Į2+2”Įii+iiiæÉµĆ£ŗ2CH4£Øg£©+O2£Øg£©?2CH3OH£Øg£©”÷H=-251.61kJ/mol£¬
¹Ź“š°øĪŖ£ŗ2CH4£Øg£©+O2£Øg£©?2CH3OH£Øg£©”÷H=-251.61kJ/mol£»
£Ø4£©¢ŁŌµē³Ųøŗ¼«·¢ÉśŃõ»Æ·“Ó¦£¬¼×“¼ŌŚøŗ¼«Ź§Č„µē×Ó£¬¼īŠŌĢõ¼žĻĀÉś³ÉĢ¼ĖįøłĄė×ÓÓėĖ®£¬øŗ¼«µē¼«·“Ó¦Ź½ĪŖ£ŗCH3OH-6e-+8OH-=CO32-+6H2O£¬
¹Ź“š°øĪŖ£ŗCH3OH-6e-+8OH-=CO32-+6H2O£»
¢Ś·“Ó¦±¾ÖŹŹĒ¼×“¼Č¼ÉÕÉś³É¶žŃõ»ÆĢ¼ÓėĖ®£¬¶žŃõ»ÆĢ¼ÓėKOH·“Ӧɜ³ÉĢ¼Ėį¼ŲÓėĖ®£¬·“Ó¦ĻūŗÄKOH£¬µē½āÖŹČÜŅŗ¼īŠŌ¼õČõ£¬µē³Ų¹¤×÷¹ż³ĢÖŠµē½āÖŹČÜŅŗpH½µµĶ£¬
¹Ź“š°øĪŖ£ŗ½µµĶ£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹµÄĮæ¼ĘĖć”¢øĒĖ¹¶ØĀÉÓ¦ÓĆ”¢Ōµē³ŲµČ£¬ŹōÓŚĘ“ŗĻŠĶĢāÄ棬עŅā¶Ō»ł“”ÖŖŹ¶µÄĄķ½āÕĘĪÕ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ĪĀ¶Č£ØK£© CO2×Ŗ»ÆĀŹ£Ø%£© n£ØH2£©/n£ØCO2£© | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | X | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÄĘ¼ÓČėĖ®ÖŠ£ŗNa+2H2OØTNa++2OH-+H2”ü | |
| B£® | Al2£ØSO4£©3ČÜŅŗÖŠ¼ÓČė¹żĮæBa£ØOH£©2ČÜŅŗ£ŗ2Al3++3SO42-+3Ba2++6OH-ØT2Al£ØOH£©3”ż+3BaSO4”ż | |
| C£® | Cl2ĶØČėĖ®ÖŠ Cl2+H2O?2H++ClO-+Cl- | |
| D£® | ĻņÅØŃĪĖįÖŠ¼Ó¶žŃõ»ÆĆĢ£ŗMnO2+4H++2Cl- $\frac{\underline{\;\;”÷\;\;}}{\;}$ Mn2++2H2O+Cl2”ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

| ĪļÖŹ | Fe£ØOH£©3 | Mn£ØOH£©2 | Co£ØOH£©2 | Ni£ØOH£©2 | MnS | CoS | NiS |
| Ksp | 4.0”Į10-38 | 2.0”Į10-13 | 3.0”Į10-16 | 5.0”Į10-16 | 1.0”Į10-11 | 5.0”Į10-22 | 1.0”Į10-22 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓėĀĮ·Ū·“Ó¦·Å³öH2µÄĪŽÉ«ČÜŅŗ£ŗNO3-”¢Al3+”¢Na+”¢SO42- | |
| B£® | Ź¹ŗģÉ«ŹÆČļŹŌÖ½±äĄ¶µÄČÜŅŗ£ŗSO42-”¢HCO3-”¢K+”¢Na+ | |
| C£® | ÖŠŠŌČÜŅŗ£ŗFe3+”¢Al3+”¢NO3-”¢SO42- | |
| D£® | ³£ĪĀĻĀ$\frac{c£Ø{H}^{+}£©}{c£ØO{H}^{-}£©}$=1”Į10-12µÄČÜŅŗ£ŗK+”¢AlO2-”¢CO32-”¢Na+”¢ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 150ml 1mol/LµÄNaClČÜŅŗ | B£® | 150ml 3mol/LKClČÜŅŗ | ||
| C£® | 75ml 2mol/LµÄNH4ClČÜŅŗ | D£® | 50ml 1mol/lCuCl2ČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÉĻŹö·“Ó¦ÖŠ£¬N2ŹĒ»¹Ō¼Į£¬Al2O3ŹĒŃõ»Æ¼Į | |
| B£® | ÉĻŹö·“Ó¦ÖŠ£¬ĆæÉś³É1 mol AlNŠč×ŖŅĘ3 molµē×Ó | |
| C£® | AlNÖŠµŖŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ+3¼Ū | |
| D£® | AlNµÄĦ¶ūÖŹĮæĪŖ41 g |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŹµŃé²Ł×÷ | ĻÖĻó | Ąė×Ó·½³ĢŹ½ |
| Ļņ³ĪĒåŹÆ»ŅĖ®ÖŠĶØČėÉŁĮæCO2ĘųĢå | ||
| ĻņĮņĖįČÜŅŗÖŠĶ¶ČėÉŁĮæMg·Ū | ||
| Ļņ“×ĖįČÜŅŗÖŠµĪ¼ÓNaOHČÜŅŗ | ĪŽĆ÷ĻŌĻÖĻó |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com