
����Ŀ���������[Ca(NO2)2]��ˮ���������Ӽ�����Ҫԭ�ϡ�ij��ȤС�����Ʊ�Ca(NO2)2���������ʽ���̽�����ش������й����⡣
�������زģ���NO+CaO2��Ca(NO2)2��2NO2+CaO2��Ca(NO3)2��
II�����������һ���������Ժͻ�ԭ�ԣ����������£�Ca(NO2)2�ܽ�I-����ΪI2��
��I2��2S2O32��=2I����S4O62��
���Ʊ�Ca(NO2)2����С����Ƶ��Ʊ�װ����ͼ��ʾ���г�װ����ȥ����
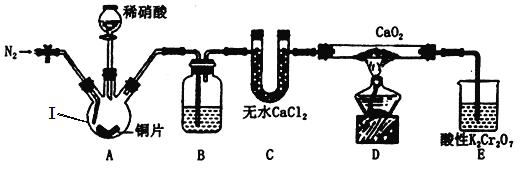
��1���������������___________________��B��ʢװ���Լ���____________________��
��2���Ʊ������йز������£���ȷ˳��Ϊ_______��c��_______��_______��_______��_______��
a����װ����ͨ��N2 b�����������еμ�ϡ���� c����ȼ�ƾ��� d��Ϩ��ƾ��� e��ֹͣͨ��N2 f���رշ�Һ©������
��3��װ��E�У�����K2Cr2O7��Һ�ɽ�ʣ���NO������NO3������Һ�ɳ�ɫ��Ϊ��ɫ��Cr3+����������Ӧ�����ӷ���ʽΪ__________________________��
��4���������̳���ͨN2��������______________��_____________��____________��
���ⶨCa(NO2)2�Ĵ��ȣ���С��ⶨ��Ʒ��Ca(NO2)2���ȵķ������£�a����ȡmg��Ʒ���ܽ⡢������250mL��b����ȡ25.00mL��Һ����ƿ�У����������V1 mLc1mol/L��KI��Һ���ữ��c���Ե���Ϊָʾ������c2mol/L��Na2S2O3��Һ�ζ�����������ƽ��ʵ�飬���ı�Һ���ƽ��ֵΪV2 mL��
��5���ⶨ��������������ʹ��ǰ�������Ƿ�©Һ����______________________��
��6���ò�Ʒ��Ca(NO2)2����������Ϊ_____________________��
���𰸡�������ƿˮ�����������ƣ�a bfde2NO + Cr2O72- + 6H+�T 2NO![]() + 2Cr3+ + 3H2O����װ���еĿ����������ɵ�NOʹ֮����D��ֹ����250mL����ƿ���ζ���
+ 2Cr3+ + 3H2O����װ���еĿ����������ɵ�NOʹ֮����D��ֹ����250mL����ƿ���ζ���![]()
��������
��װ����ͨ��N2������װ���е���������ȼ�ƾ��ƣ���������ƿ�еμ�ϡ���ᣬͭ��ϡ���ᷴӦ����һ���������壬ͨ��װ��B�dz�ȥ�����е�����������ͨ��װ��C(��ˮ�Ȼ���)���������װ��D�й������Ʒ�Ӧ����Ca(NO2)2�����ͨ�������ظ���ؽ�ʣ���NO������NO3-����Һ�ɳ�ɫ��Ϊ��ɫ(Cr3+)��ֹͣͨ�뵪����
(1)����ͼʾ��������Ϊ������ƿ���ɷ�����֪B�dz�ȥһ�������л��е�����������B��ʢ�ŵ��Լ�������ˮ���������ƣ������dz�ȥHNO3���ʴ�Ϊ��������ƿ������ˮ���������ƣ�
(2)��װ����ͨ��N2������װ���е���������ȼ�ƾ��ƣ���������ƿ�еμ�ϡ���ᣬͭ��ϡ���ᷴӦ����һ���������壬ͨ��װ��B(����������Һ)��ȥ�����е��������壬ͨ��װ��C(��ˮ�Ȼ���)��������������װ��D�й������Ʒ�Ӧ����Ca(NO2)2�����ͨ�������ظ���ؿɽ�ʣ���NO��������������ȷ����Ϊ��a c b f d e���ʴ�Ϊ��a��b��f��d��e��
(3)��Ӧ��Cr2O72-����ԭ��Cr3+��NO��������NO3-�����ӷ�Ӧ����ʽΪ��2NO+Cr2O72-+6H+=2Cr3++NO3-+3H2O���ʴ�Ϊ��2NO+Cr2O72-+6H+=2Cr3++NO3-+3H2O��
(4)װ���к��п���������������������һ������������ͨ�뵪����Ŀ�����ų�װ������������ֹ�佫���ɵ�һ�������������ɶ��������������Ǵ���װ���е�NOʹ֮����D�з�Ӧ�������ֹ���������ã��ʴ�Ϊ������װ���е�����������װ���е�NOʹ֮����D����ֹ������
(5)��������ԭ�ζ����ⶨ�����У�����������ʹ��ǰ�������Ƿ�©Һ����250mL����ƿ���ζ��ܣ��ʴ�Ϊ��250mL����ƿ���ζ��ܣ�
(6)�����������£�Ca(NO3)2�ܽ�I-����ΪI2��S2O32-�ܽ�I2��ԭΪI-��֪������2NO2-��I2��2S2O32-������Na2S2O3�����ʵ���Ϊc2molL-1��V2��10-3L=0.001c2V2mol����Ca(NO2)2�����ʵ���Ϊ0.001c2V2mol��![]() ����Ca(NO2)2����������Ϊ
����Ca(NO2)2����������Ϊ![]() ��100%=
��100%=![]() %���ʴ�Ϊ��
%���ʴ�Ϊ��![]() %��
%��


 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д� ����С����ͬ������ϵ�д�
����С����ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�� �ֽ���ͬ����CO2��g����H2��g���ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У��������·�Ӧ��CO2(g��+H2��g��![]() [Failed to download image : ]CO��g��+H2O��g�����õ������������ݣ�
[Failed to download image : ]CO��g��+H2O��g�����õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
CO2 | H2 | CO | |||
1 | 800 | 4 | 2.5 | 1.5 | 5 |
2 | 830 | 2 | 2 | 1 | 3 |
3 | 830 | 2 | 2 | 1 | 1 |

��1��ʵ��1�У�ƽ�ⳣ��K=0.9��v��H2��=0.15mol/��Lmin���÷�Ӧ������ӦΪ______��������š����ȷ�Ӧ��
��2��ʵ��3��ʵ��2��ȣ��ı������������___________________________
����һ��������ɣ������÷�Ӧ����ͼ��ʾ�Ĺ�ϵ������ͼ��Y���ʾ___________________________
��3�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������______����ѡ�۷֣���
a��������ѹǿ���� b�����������c��CO ������
c��v��H2����=v��H2O���� d��c��CO2��=c��CO��
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2��c��H2��=c��CO��c��H2O���ɴ˿����жϴ�ʱ���¶�Ϊ______�������������䣬�����¶ȣ�ԭ��ѧƽ����______��Ӧ�����ƶ�����������桱���������ڻ��������ܶ�______�����������С�����䡱����
��5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�������Һ�ĵ�����װ���У�����ijһ�������Һ����μ�����һ����Һʱ����ƹ������䰵��Ϩ�������������

A. ��������μ���ʳ����Һ
B. NH4Cl��Һ�м���������NaOH��Һ
C. Ba(OH)2��Һ�е���H2SO4��Һ������
D. ��������μ��백ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ����£�����ͼ��ʾ��װ���У���ʹ�������ƣ����´ﵽƽ��ʱ��������ֵ���������

A. ��������Ŀ B. HCO3����ˮ��ƽ�ⳣ�� C. ��Һ��pH D. c(HCO3��)/c(H2CO3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ӦFe��H2SO4��FeSO4��H2���������仯���ƣ���ͼ��ʾ��

�ٸ÷�ӦΪ________��Ӧ������ȡ����ȡ�����
����Ҫʹ�÷�Ӧ�ķ�Ӧ���ʼӿ죬���д�ʩ���е���________������ĸ����
A������ƬΪ���� B����ϡ����Ϊ98%��Ũ���� C�������¶�
��2����������������ɴ���ʹ����һ������ȼ�ϵ�أ��乹����ͼ��ʾ��A��B�����缫���ɶ��̼����ɣ��õ�ص�������ӦʽΪ��_______________________________��

��3��300 ��ʱ����A��B�����������ں����ܱ������У��������·�Ӧ��3A(g)��B(g)![]() 2C(g)��2D(g)��2 minĩ�ﵽƽ�⡣
2C(g)��2D(g)��2 minĩ�ﵽƽ�⡣
��300��ʱ���÷�Ӧ��ƽ�ⳣ������ʽΪK��________��
����֪K300��<K350������H____0(�>����<��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���������̿���Ҫ�ɷ���MnO2��������Al2O3��SiO2������п����Ҫ�ɷ���ZnS��������FeS��CuS�����ʣ�Ϊԭ���Ʊ�MnO2��Zn���ɵ��ԭ�ϣ�������������£�
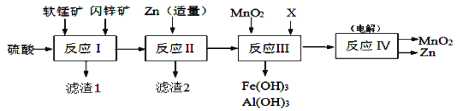
��֪����Ӧ�������н���Ԫ�ؾ���������ʽ���ڡ��йس�����Ksp[Al(OH)3]��1.0��10��33��Ksp[Fe(OH)3]��3.0��10��39��Ksp[Mn(OH)2]��2.0��10��13��Ksp[Zn(OH)2]��1.0��10��17��Ksp(MnCO3)��2.0��10��11��Ka1(H2CO3)��4.0��10��7��Ka2(H2CO3)��5.6��10��11���ش��������⣺
��1������1�г���SiO2���⣬����һ�ֵ���ɫ���ʣ�����������MnO2��CuS�����Ṳ��ʱ�����ģ���д���÷�Ӧ�����ӷ���ʽ____________________________��
��2����Ӧ���м�����������п��Ŀ����Ϊ�˻���ij�ֽ���������2����Ҫ�ɷ���___________��
��3����Ӧ����MnO2��������_______________________������Ӧ����Һ��Mn2����Zn2����Ϊ0.1mol��L��1���������ҺpH��ΧΪ_______________����Һ�У���һ�����ӵ�Ũ��С��10��6mol/Lʱ����Ϊ�Ѳ����ڣ���X������_________��������ĸ���ţ�
a��MgO b��Zn(OH)2 c��Cu2(OH)2CO3 d��MnCO3
��4����Ӧ���е缫���Ƕ��Ե缫��д�������缫��Ӧʽ________________________�������տ���ѭ�����õ�������MnO2��Zn��_________��
��5��MnCO3�ж�����;����ˮ���������г���NH4HCO3��Һ��Mn2+ת��ΪMnCO3���÷�Ӧ�����ӷ���ʽΪ______����ͨ�������й����ݼ�Ҫ����˵���÷�Ӧ�ܽ��е�ԭ��____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������

A. ͼ�ױ�ʾij���ȷ�Ӧ������(a)���д���(b)ʱ��Ӧ�������仯
B. ͼ�ұ�ʾ�����£�0.1mol/LNaOH��Һ�ζ�20.00mL0.1mol/L������Һ�ĵζ�����
C. ͼ����ʾij���淴Ӧ�ķ�Ӧ������ʱ��ı仯��ϵ��t0ʱ�̸ı��������ʹ���˴���
D. ͼ����ʾһ�������������ˮϡ�����С���Һ���������仯���ߣ��Ҵ������̶ȣ�a<b<c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о���ѧϰС���ij��ɫˮ���ijɷֽ��м��飬��֪��ˮ����ֻ���ܺ���K+��Mg2+��Fe3+��Cu2+��Al3+��Ag+��Ca2+��CO![]() ��SO
��SO![]() ��Cl���е����������ӣ���С��ͬѧȡ100mLˮ������ʵ�飬��ˮ�����ȵμ����ᱵ��Һ���ٵμ�1mol/L�����ᣬʵ������г��������ı仯�������ͼ��ʾ������ʾ:Al3+��CO
��Cl���е����������ӣ���С��ͬѧȡ100mLˮ������ʵ�飬��ˮ�����ȵμ����ᱵ��Һ���ٵμ�1mol/L�����ᣬʵ������г��������ı仯�������ͼ��ʾ������ʾ:Al3+��CO![]() �����棩
�����棩

��1��ˮ����һ�����е���������_____�������ʵ���Ũ��֮��Ϊ_____��
��2��д��BC������ʾ��Ӧ�����ӷ���ʽ��_____��
��3����B��C��仯������������������Ϊ_____��
��4���Ը���ʵ�����Ʋ�K+�Ƿ���ڣ�_____���������������������������ڣ�K+�����ʵ���Ũ��c��K+���ķ�Χ��_____������K+�����ڣ��ػش���ʣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������ͼ��ʾת����ϵ(��Ӧ������)��
��֪����X��Y��Z��W��Ϊ����������£�X�Ǻ���ɫ���壻Y��ʹ����ʯ��ˮ����ǵ�����ʹƷ����Һ��ɫ������Է�����������<�ҡ��۽���Ũ��Һ¶���ڿ�����һ��ʱ�䣬������СŨ�Ƚ��ͣ����ҵ�Ũ��Һ¶���ڿ�����һ��ʱ�䣬��������Ũ�Ƚ��͡���������пհף�

��1��Z��(д��ѧʽ)��______________��
��2�����ҵ�Ũ��Һ¶���ڿ�����һ��ʱ�䣬��������Ũ�Ƚ��ͣ������ҵ�Ũ��Һ����__________�ԡ������������ʿ��Խ���__________��(����ĸ)ʵ�������
A���ۻ���Ƭ B������Ba2�� C�����ﰱ�� D����������
��3����X��Z�ķ�Ӧ�У���������X�뱻��ԭ��X�����ʵ���֮����________________��
��4��W�����ڹ�ҵ������������ճ�ʪ�����е�Br2��д���÷�Ӧ�����ӷ���ʽ��______________���÷�Ӧ�ܺõؽ���˻������⣬������ҵ����������_______________�����⡣
��5��д��M���Ũ��Һ�ڼ��������·�Ӧ�Ļ�ѧ����ʽ��______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com