
已知25 ℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨,s)+O2(g)===CO2(g) ΔH=-393.51 kJ·mol-1
C(金刚石,s)+O2(g)===CO2(g) ΔH=-395.41 kJ·mol-1
据此判断,下列说法正确的是( )
A.由石墨制备金刚石是吸热反应;等质量 时,石墨的能量比金刚石的低
时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
把200 mL NH4HCO3和Na2CO3的混合溶液分成两等份,取一份加入含a mol NaOH的溶液恰好反应完全;取另一份加入含b mol HCl的盐酸恰好反应完全。该混合溶液中c(Na+)为( )
A.(10b-5a)mol·L-1 B.(2b-a)mol·L-1
C.(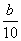 -
-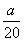 )mol·L-1 D.(5b-
)mol·L-1 D.(5b-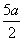 )mol·L-1
)mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚是一种绿色、可再生的新能源。下图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔Pt电极)。该电池工作时,下列说法不正确的是( )
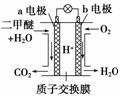
A.a电极为该电池正极
B.当有0.4 mol电子转移时,b极消耗2.24 L O2
C.电池工作时,a电极反应式:CH3OCH3-12e-+3H2O===2CO2↑+12H+
D.电池工作时,燃料电池内部H+从a电极移向b电极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.化学反应中的能量变化,都表现为热量的变化
B.需要加热才能发生的反应,一定是吸收能量的反应
C.释放能量的反应在常温下一定很容易发生
D.是吸收能量的反应还是释放能量的反应,须看反应物的总能量和生成物的总能量的相对大小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列体系加压后,对化学反应速率没有明显影响的是( )
A.2SO2(g)+O2(g)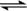 2SO3(g)
2SO3(g)  B.I2(g)+H2(g)
B.I2(g)+H2(g)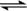 2HI(g)
2HI(g)
C.CO2(g)+H2O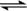 H2CO3 D.H++OH-
H2CO3 D.H++OH- 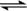 H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知299 K时,合成氨反应 N2 (g ) + 3H2 ( g ) 2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行
2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行 反应,测得反应放出的热量为(忽略能量损失)( )
反应,测得反应放出的热量为(忽略能量损失)( )
A.一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
简答:
在水溶液中,橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72- + H2O 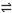 2CrO42- + 2H+ 把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
2CrO42- + 2H+ 把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
(1) 向上述溶液中加入NaOH溶液,溶液呈_________色,因为加入NaOH溶液反应中________的浓度________(填增大或减小)平衡向_____ _方向移动, 的浓度增大, 的浓度减小。
(2)向原溶液中逐滴加入Ba(NO3)2 溶液(已知BaCrO4为黄色沉淀),则平衡
向 移动,溶液 颜色将_______________ 。
颜色将_______________ 。
(3) 在一定条件下,N2 和H2发生如下反应:
N2(g) + 3H2 (g)  2NH3 (g) ΔH =-92.4 kJ/mol
2NH3 (g) ΔH =-92.4 kJ/mol
①该反应中ΔH的含义是
A.该反应达到平衡时放出的热量
B.该反应达到平衡时吸收的热量
C.该条件下,N2 和H2反应生成2molNH3时放出的热量
D.该条件下,N2 和H2反应生成2molNH3时吸收的热量
②达到平衡后,在其他条件不变的情况下降低温度,正逆化学反应速率都
(填增大、减小或不变),平衡向 方向移动;重新
建立新的平衡后,在其他条件不变的情况下增大压强,正逆化学反应速
率都 (填增大、减小或不变),平衡向 方向移动。若平衡后,在其他条件不变的情况下加入催化剂,正逆化学反应速率都
(填增大、减小或不变),平衡 移动(填是或否)。
“中和热”是热化学中的一个重要概念。在稀溶液里,酸、碱发生中和反应生成1mol 水,这时反应放出的热叫中和热。以下关于中和热的叙述,正确的是
A.在稀溶液中所有酸和碱反应的中和热都相等
B.在稀溶液中强酸和强碱反应的中和热都相等
C.在稀溶液中1mol 酸和1mol 碱反应放出的热量都相等
D.将浓硫酸滴入氢氧化钠浓液中刚好生成1mol 水时,产生的热量即中和热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com