
| A. | CH3CH2Br的沸点比CH3CH3的沸点高 | |
| B. | 所有卤代烃都能够发生水解反应和消去反应 | |
| C. | 溴乙烷与Na0H水溶液共热生成乙烯 | |
| D. | 在溴乙烷中加入AgN03溶液,立即产生淡黄色沉淀 |
分析 A.均为分子构成的物质,相对分子质量大的沸点高;
B.含1个C的卤代烃不能发生消去反应;
C.与Na0H水溶液共热,发生水解反应;
D.溴乙烷不能电离出溴离子.
解答 解:A.均为分子构成的物质,相对分子质量大的沸点高,则CH3CH2Br的沸点比CH3CH3的沸点高,故A正确;
B.含1个C的卤代烃不能发生消去反应,但卤代烃可发生水解反应,故B错误;
C.与Na0H水溶液共热,发生水解反应生成乙醇,故C错误;
D.溴乙烷不能电离出溴离子,则不能与硝酸银反应,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、官能团与性质等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 玛瑙手饰所用材料的主要成分为硅酸盐 | |
| B. | 汽油去油污、焰色反应、煤的气化均属于物理变化 | |
| C. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 | |
| D. | 利用太阳能电池电解法将CO和H2O转化为甲酸的能量转化方式只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氯甲烷有两种同分异构体 | |
| B. | 苯和苯的同系物均能使酸性高锰酸钾溶液褪色 | |
| C. | 用核磁共振氢谱不能鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 一定条件下,溴乙烷既能发生取代反应又能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
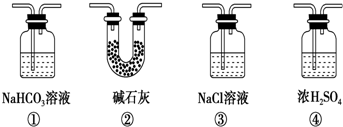
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥③②⑤④⑦ | B. | ①⑥④②⑤③⑦ | C. | ①⑥④⑤②③⑦ | D. | ①⑥③④⑤②⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
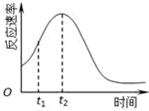 已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应.某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液体积/mL | 0.01mol/LKMnO4 溶液体积/mL | 蒸馏水体积/mL | 待测数据(混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | A | B | C | 30 | t2 |
| ③ | 常温 | 2 | 40 | D | E | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com