
����Ŀ����ͼװ���У��������ڳ���0.1mol NO���壬�������װ��һ����Na2O2����A������ͨ��CO2���壮�����£��������л���������D�����ƶ���������C��ʱ���������С����С��Ϊԭ�����![]() ������������ʵ���������2.24g����CO2�ļ���ͨ�룬�������������ƶ�����֪��2Na2O2+2CO2�T2Na2CO3+O2 2NO+O2�T2NO2 2NO2
������������ʵ���������2.24g����CO2�ļ���ͨ�룬�������������ƶ�����֪��2Na2O2+2CO2�T2Na2CO3+O2 2NO+O2�T2NO2 2NO2![]() N2O4�������ǻ�����Ħ��������˵������ȷ���ǣ�������
N2O4�������ǻ�����Ħ��������˵������ȷ���ǣ�������
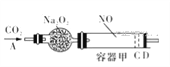
A. ������D���ƶ���C���Ĺ����У�ͨ��CO2���Ϊ2.24L����״����
B. NO2ת��ΪN2O4��ת����Ϊ20%
C. ��������C������ͨ��0.01mol CO2����ʱ����ǡ�ûص�D��
D. ���ı�������Na2O2������Ҫͨ�����ڼ��������¶ȼ�ͨ��CO2������ʹ����������D��C���ִ�C��D���ƶ�����Na2O2������Ӧ����1.56g
���𰸡�D
��������A. ��ͨ���״����CO2��������Ϊx���������������Ϊy����
2Na2O2 + 2CO2 = 2Na2CO3+O2 ��m
2��22.4L 22.4L 56g
x y 2.24g
����56g:2.24g=2��22.4L:x�����x=1.792L��56g:2.24g=22.4L:y�����y=0.896L��ͨ���״���µ�CO2����1.792L����A����B. ��A�����֪���������������ʵ���n(O2)=0.896L
��22.4L/mol=0.04mol��2NO + O2 = 2NO2
2 1 2
0.08mol 0.04mol 0.08mol
0.1mol>0.08mol������NO����������NO2�����ʵ���Ϊ0.08mol��
2NO2![]() N2O4 ��n
N2O4 ��n
2 1
0.02mol 0.1mol��(19/10)=0.01mol������NO2ת��ΪN2O4��ת����Ϊ0.02mol��0.08mol��100%=25%����B����C. ��������C����������ټ�С����������Na2O2����ȫ��Ӧ��������C��D�ƶ������������2NO2![]() N2O4ƽ�������ƶ���ʹ�������ʵ�����������������Dʱ���������ʵ���������0.01mol���������CO2��С��0.01mol����C����D. ʵ�ִ�D��C���ƶ���ֻ��ͨ������ʹ2NO2
N2O4ƽ�������ƶ���ʹ�������ʵ�����������������Dʱ���������ʵ���������0.01mol���������CO2��С��0.01mol����C����D. ʵ�ִ�D��C���ƶ���ֻ��ͨ������ʹ2NO2![]() N2O4��ƽ�������ƶ�(�˷�ӦΪ���ȷ�Ӧ)��������ʱ2NO2
N2O4��ƽ�������ƶ�(�˷�ӦΪ���ȷ�Ӧ)��������ʱ2NO2![]() N2O4 ��n
N2O4 ��n
2 1
0.02mol 0.1mol��(19/10)��������������Ӧ��0.02mol��NO2������ת����ϵʽ��֪��2Na2O2��O2��2NO��2NO2��������ҪNa2O20.02mol��������������СֵΪ0.02mol��78g/mol=1.56g����D��ȷ����ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ����ϡ���ḯʴп���õ��� ��ij��ѧ��ȤС�����ø÷�Һ(���������� Cl����Fe3��)��ȡ Zn(NO3)2��6H2O �Ĺ������£�
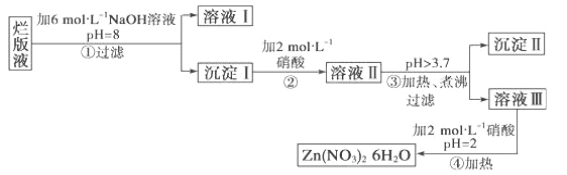
��֪��Zn(NO3)2��6H2O ��һ����ɫ���壬ˮ��Һ�����ԣ�Zn(NO3)2 ����Ӧ���õ��IJ��� Zn(OH)2 ����
���ԣ�Fe3+�� PH=3.7 ʱ������ȫ������
��1���÷�Һ���ʵ���Ҫ�ɷ���______(�ѧʽ)��
��2���ڲ������б��� pH��8 ��Ŀ����__________________________________________��
��3��������ijɷ���________________________________________��
��4���������м��ȡ���е�Ŀ����______________________________________��
��5�������ܱ��� pH��2 ��Ŀ����_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��װ��a��b��c�зֱ�ʢ���Լ�1��2��3������ͼ��ʾ��װ�ý���ʵ��(�г�������ȥ����Ҫʱ�ɼ���)���ܴﵽ��Ӧʵ��Ŀ�ĵ���
ѡ�� | �Լ�1 | �Լ�2 | �Լ�3 | ʵ��Ŀ�� | װ�� |
A | Ũ | CuƬ | KI-������Һ | ��֤ |
|
B | ���� | ʯ��ʯ | ���� | �Ʊ� | |
C | ϡ���� | ��ҺX | ����ʯ��ˮ | ��֤��ҺX���Ƿ��� | |
D | 70%���� |
| ���� | ֤�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��R��X��Y��Z�����ڱ������λ����ͼ��ʾ����֪��Y������������Ӧ��ˮ���������ǿ�Ӧ��������ǿ�ᷴӦ������˵������ȷ����

A. ����̬�⻯������ȶ��ԣ�R < X
B. ��ҵ�ϲ��õ�ⷨұ������Y
C. Y��Z�ļ���������ˮ�д�������
D. RZ2 �Ǻ����Լ��Ĺ��ۻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����������� ��
A. NaHCO3��Һ��ˮϡ�ͣ�c(Na+)��c(HCO3-)�ı�ֵ����
B. Ũ�Ⱦ�Ϊ0.1mo/L��NaHCO3��Na2CO3�Ļ����Һ����2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)]
C. 95��ʱ��Kw=1.0��10-12.����100���pH=a��ijǿ����Һ��1���pH=b��ijǿ����Һ��Ϻ���Һ�����ԣ�����ǰ:a+b=12
D. ��Na2SO3ϡ��Һ�У�c(OH-)=c(H+)+cCHSO3-)+2c(H2SO3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(H3PO2)��һԪ��ǿ�ᣬ���н�ǿ��ԭ�ԣ������й�˵����ȷ����( )
A. ������ĵ��뷽��ʽΪ��H3PO2=H++H2PO2-
B. NaH2PO2�Ǵ���������Σ���ˮ��Һ������
C. ����������������Һ��Ӧ�ɵô������Σ���Ӧ�Ļ�ѧ����ʽΪ��
P4+9NaOH=3Na2PO2+PH3��+3H2O
D. ����(H3PO2)���л�ѧ������Ӧ�У�1mol H3PO2��ԭ4mol Ag+����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ�����ӵ����ʵ���Ũ�ȴ�С��ϵ��ȷ������ ��
A. �����ʵ���Ũ�ȵ�������Һ����H2CO3 ��Na2CO3 ��NaHCO3 ��(NH4)2CO3������c(CO32-)�Ĵ�С��ϵΪ����>��>��>��
B. pH=2 ��H2C2O4��Һ��pH=12 ��NaOH ��Һ����������c(H+)+c(Na+)=c(OH-)+c(HC2O4-)+c(C2O42-)
C. ��0.2mo/L ��NaHCO3 ��Һ�м�������0.1mo/L ��NaOH ��Һ��c(CO32- )>c(HCO3-)>c(OH-)>c(H+)
D. �����£���Ũ�ȵ�CH3COOH��CH3COONa ��Һ�������ϣ���Һ��pH<7��c(CH3COOH)+c(OH-)>c(H+)+c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ҩƷ�ı��������ǣ� ��
A.������ˮ��
B.�ƾ�����ȼ��Ӧ���ڷ�����Զ���Դ
C.����ء�����鱗�Ҫͬ��ȼ���ţ�����ը
D.Ũ����������������ƶ���Ҫ�ܷⱣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ԫ����ˮ�еĵ��뷽��ʽΪ��H2B=H++HB-�� HB-![]() H++B2-���ش�����������
H++B2-���ش�����������
��1��Na2B ��Һ��__________���������ԡ����ԡ�������������������������ӷ���ʽ��ʾ����____________________________________________��
��2����0.1mol/L ��Na2B ��Һ�У���������Ũ�ȹ�ϵ��ȷ����__________��
A.c(B2-)+c(HB�C)+c(H2B)=0.1 mol/L
B.c(Na+)+ c(H+)= c(HB�C)+c(OH�C) +2c(B2-)
C.c(Na+)=2c(HB�C) +2c(B2-)
D. c(H+)=c(OH�C)-c(HB�C)-2c(H2B)
��3����֪0.1 mol/LNaHB��Һ��pH=2����0.1 mol/LH2B��Һ��c(H+)������_____0.11mol/L����������������������=������������_______________________��
��4��0.1mol/LNaHB��Һ�и�������Ũ�ȴ�СΪ_________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com