

| A. | 电解过程中,d电极附近溶液变红 | |
| B. | c电极上的电极反应式为:2H++2e-=2H2↑ | |
| C. | a为负极、d为阳极 | |
| D. | 电解过程中,氯离子浓度不变 |
分析 A、电解池中溶液中阳离子移向阴极;
B、依据电解池中电解原理分析判断,c电极为阳极,溶液中的氯离子放电生成氯气;
C、依据装置图中电流流向分析电极名称,与电源正极连接的为阳极;
D、溶液中铜离子在阴极得到电子析出铜,氯离子在阳极失电子生成氯气.
解答 解:A、电解过程中,d为电解槽的阴极,反应电极反应为2H++2e-═H2↑,d电极附近溶液变红,故A正确;
B、电解过程中c电极是阳极,溶液中氯离子失电子发生氧化反应生成氯气,故B错误;
C、装置图中电流流向判断a为电源正极,与a连接的电极c为阳极;b为电源负极,与负极相连的电极d为阴极,故C错误;
D、溶液中氢离子在阴极得到电子生成氢气,氯离子在阳极失电子生成氯气,氯离子浓度减小,故D错误;
故选A.
点评 本题考查电解原理的分析应用,正确分析判断电极名称、电极反应和电极产物是解题关键,题目难度中等.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:填空题
 用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在上述两个反应中,水既不是氧化剂也不是还原剂 | |
| B. | 在上述两个反应中,氧化产物都是H3PO4 | |
| C. | 在反应(2)中,当有5mol CuSO4发生反应时,共转移10mol电子 | |
| D. | 在上述两个反应中,氧化剂都只有硫酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$2SO3(g)反应过程的能量变化如图所示.请回答下列问题:
已知2SO2(g)十O2(g)$?_{催化剂}^{加热}$2SO3(g)反应过程的能量变化如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mL | B. | 45mL | C. | 65mL | D. | 80mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
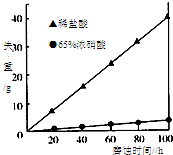 按要求回答下列问题:
按要求回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com