
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含有少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如下:
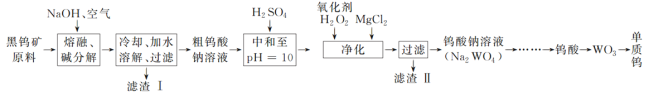
已知:①滤渣Ⅰ的主要成分是Fe2O3、MnO2;②上述流程中,钨的化合价只有在最后一步发生改变;③常温下钨酸溶于水。
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为______,请写出FeWO4在熔融条件下发生碱分解生成Fe2O3的化学方程式:_____________。
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子含有SiO32—、HAsO32—、HAsO42—等,则“净化”过程中,加入H2O2时发生反应的离子方程式为HAsO32—+H2O2===HAsO42—+H2O,滤渣Ⅱ的主要成分是________。
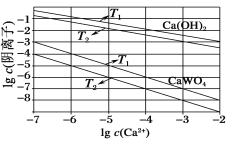
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度的升高而减小。如图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。则:
①T1_____T2(填“>”或“<”);T1℃时Ksp(CaWO4)=______。
②向钨酸钠溶液中加入石灰乳会得到大量钨酸钙,发生反应的离子方程式为__________。
【答案】+6 4FeWO4+O2+8NaOH![]() 2Fe2O3+4Na2WO4+4H2O HAsO32—+H2O2===HAsO42—+H2O MgSiO3、MgHAsO4 1×10-10 WO42—+Ca(OH)2===CaWO4+2OH-
2Fe2O3+4Na2WO4+4H2O HAsO32—+H2O2===HAsO42—+H2O MgSiO3、MgHAsO4 1×10-10 WO42—+Ca(OH)2===CaWO4+2OH-
【解析】
由黑钨矿冶炼钨的工艺流程:向黑钨矿中(主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、As的化合物)中加入氧气和氢氧化钠,钨酸亚铁和氢氧化钠、氧气反应生成氧化铁和钨酸钠,钨酸锰和氢氧化钠反应生成钨酸钠和二氧化锰,Si、As生成相应的盐,水浸时,氧化铁和二氧化锰不溶于水,钨酸钠溶于水,故过滤后得到的滤液主要含钨酸钠,滤渣I的主要成份是Fe2O3、MnO2;滤液中钨酸钠和浓硫酸反应生成钨酸和硫酸钠;加入过氧化氢,HAsO32-被氧化为HAsO42-,加入氯化镁,生成难溶于水的MgSiO3、MgHAsO4,过滤,滤渣Ⅱ为:MgSiO3、MgHAsO4,滤液为钨酸钠,酸化,加热分解产生三氧化钨和水,用还原剂还原三氧化钨生成钨,据此分析解答。
(1)由流程图和信息知,钨的化合价只有在最后一步发生改变,WO3中W的化合价为+6,则钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+6,Fe的化合价为+2,FeWO4在熔融条件下发生碱分解反应,由流程图可知有空气中的氧气和NaOH参加反应,生成Fe2O3、Na2WO4,氧化剂为O2,配平方程式得4FeWO4+8NaOH+O2![]() 2Fe2O3+4Na2WO4+4H2O;
2Fe2O3+4Na2WO4+4H2O;
(2)加入H2O2时阴离子HAsO32-能被氧化为HAsO42-,离子方程式为HAsO32-+H2O2=== HAsO42-+H2O;加入MgCl2生成沉淀,结合溶液中存在的阴离子,滤渣Ⅱ是MgSiO3、MgHAsO4;
(3)①氢氧化钙和钨酸钙的溶解度均随温度升高而减小,Ksp值也随之减小,由图象可知,在阳离子浓度相同时T1 ℃的阴离子浓度大于T2 ℃的阴离子浓度,则T1 ℃对应的Ksp大于T2 ℃对应的Ksp,所以T1<T2;取T1 ℃时的起点,Ksp(CaWO4)=c(Ca2+)×c(WO42)=10-7×10-3=10-10;
②钨酸钠溶液中加入石灰乳,石灰乳微溶,不可拆,离子方程式为WO42+Ca(OH)2===CaWO4+2OH-。


科目:高中化学 来源: 题型:
【题目】氨在化肥生产、储氢及环境治理等领域发挥着重要作用。
(1)中科院固体研究所的赵惠军和张海民研究团队以MoS2为催化剂,通过调节催化剂/电解质的表界面相互作用,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图1。将Na2SO4溶液换成Li2SO4溶液后,反应速率明显加快的主要原因是加快了下列__转化的反应速率(填标号)。
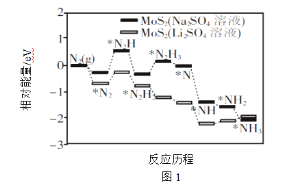
A.N2→*N2 B.*N2→*N2H C.*N2H3→*N D.*NH→*NH2
(2)2017年Dr.KatsutoshiNagaoka等带领的研究团队开发了一种可以“快速启动的氨制氢工艺”。
已知:NH3(g)=![]() H2(g)+
H2(g)+![]() N2(g) ΔH1=+45.9kJ·mol-1
N2(g) ΔH1=+45.9kJ·mol-1
NH3(g)+![]() O2(g)=
O2(g)=![]() H2O(g)+
H2O(g)+![]() N2(g) ΔH2=-318kJ·mol-1
N2(g) ΔH2=-318kJ·mol-1
则快速制氢反应NH3(g)+![]() O2(g)=H2(g)+
O2(g)=H2(g)+![]() H2O(g)+
H2O(g)+![]() N2(g)的ΔH=___kJ·mol-1。
N2(g)的ΔH=___kJ·mol-1。
(3)氨在高温下分解可以产生氢气和氮气。1100℃时,在钨丝表面NH3分解的半衰期(浓度减小一半所需时间)如下表所示:

表中的t5的值为___。c(NH3)的值从2.28×10-3变化至1.14×10-3的过程中,平均反应速率v(H2)=___ mol·L-1·s-1(保留三位有效数字)。
(4)氨催化氧化时会发生两个竞争反应:
Ⅰ:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.0kJ·mol-1
4NO(g)+6H2O(g) ΔH=-905.0kJ·mol-1
Ⅱ:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH=-1266.6kJ·mol-1
2N2(g)+6H2O(g) ΔH=-1266.6kJ·mol-1
为分析某催化剂对反应的选择性,在1L密闭容器中存入1mol氨气和2mol的氧气,测得有关物质的物质的量随温度变化的关系如图2。
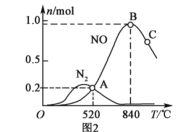
①该催化剂在低温时,选择反应___(填“Ⅰ”或“Ⅱ”)。
②520℃时,4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)的平衡常数K=___(只需列出数字计算式,无需计算结果)。
4NO(g)+6H2O(g)的平衡常数K=___(只需列出数字计算式,无需计算结果)。
(5)华南理工大学提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图3所示。

①IrRu惰性电极有吸附O2的作用,该电极上的反应为__。
②理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用电化学法还原CO2是一种使CO2资源化的方法。下图是利用此法制备ZnC2O4的示意图(电解液不参与反应)。下列说法中正确的是

A. Zn与电源的负极相连
B. ZnC2O4在交换膜右侧生成
C. 电解的总反应为2CO2+Zn![]() ZnC2O4
ZnC2O4
D. 通入11.2 L CO2时,转移0.5 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )
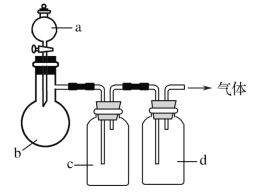
选项 | A | B | C | D |
气体 | CO2 | Cl2 | NH3 | NO |
a | 盐酸 | 浓盐酸 | 饱和NH4Cl溶液 | 稀硝酸 |
b | CaCO3 | MnO2 | 消石灰 | 铜屑 |
c | 饱和Na2CO3溶液 | NaOH溶液 | H2O | H2O |
d | 浓硫酸 | 浓硫酸 | 固体NaOH | 浓硫酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末X中可能含有Fe、Fe2O3、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下:
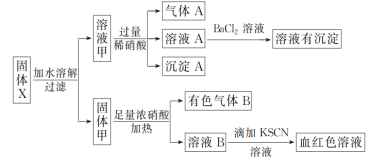
根据上述实验,以下说法正确的是( )
A.气体A一定只是NO
B.由于在溶液A中加入BaCl2溶液有沉淀产生,因此可以判断溶液甲中含有K2SO3
C.若向固体甲中加入足量浓盐酸,再加KSCN溶液,没有血红色,则证明原混合物中一定没有Fe2O3
D.溶液甲中一定含有K2SiO3,可能含有KAlO2、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:
是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:
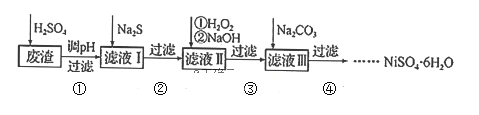
已知:①![]() 是一种不溶于水易溶于强酸的沉淀;②已知
是一种不溶于水易溶于强酸的沉淀;②已知![]() ,
,![]() 的
的![]() 。
。
(1)Ni的原子序数为28,则它在周期表中的位置为______,写出H2O2的结构式______。
(2)步骤②,向滤液I中加入适量![]() 溶液的目的是除去Cu2+和
溶液的目的是除去Cu2+和![]() ,其中除去Cu2+的离子方程式为______;加
,其中除去Cu2+的离子方程式为______;加![]() 之前需控制pH不能太低的目的是______。
之前需控制pH不能太低的目的是______。
(3)步骤③的目的是除去Fe和Cr,温度不能太高的原因是___________。若在![]() 时,调pH=4除去铁,此时溶液中
时,调pH=4除去铁,此时溶液中![]() ______________。
______________。
(4)粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度镍,下列叙述正确的是_ ___(已知:氧化性Fe2+<Ni2+<Cu2+)
A.粗镍作阳极,纯镍作阴极
B.阳极发生还原反应,其电极反应式:![]()
C.电解过程中,阳极质量的减少与阴极质量的增加相等
D.电解后,溶液中存在的金属阳离子只有Cu2+和![]()
E.电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时,O2—可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
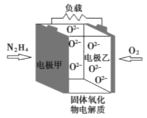
A.电池内的O2—由电极甲移向电极乙
B.电池总反应为N2H4+2O2=2NO+2H2O
C.当甲电极上有1molN2H4消耗时,标况下乙电极上有22.4LO2参与反应
D.电池外电路的电子由电极乙移向电极甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
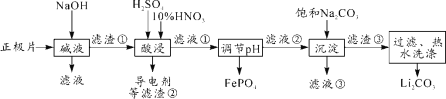
(1)从“正极”可以回收的金属有___________。
(2)“碱溶”时Al箔溶解的离子方程式_________。
(3)“酸浸”时产生标准状况下2.24L NO时,则被氧化的LiFePO4为______mol。(其他杂质不与HNO3反应)
(4)实验测得滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则滤液③中c(CO32-)=________ mol·L-1。 [Ksp(Li2CO3)=1.6×10-3]
(5)磷酸亚铁锂电池总反应为:LiFePO4+6C ![]() Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向_______(填“阳极”或“阴极”);放电时,正极反应式为_______。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向_______(填“阳极”或“阴极”);放电时,正极反应式为_______。
(6)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取1.40g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030 mol·L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
① 实验中加入HgCl2饱和溶液的目的是__________。
② 磷酸亚铁锂电池中铁的含量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20 mL 0.01 mol/LCH3COOH溶液中逐滴加入 KOH溶液,其pH变化曲线如图(1)所示(忽略温度变化)。请回答下列有关问题:
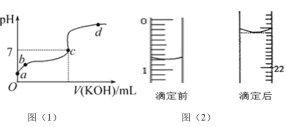
(1)![]() 点溶液中c(H+)约为______________。
点溶液中c(H+)约为______________。
(2)![]() 、c、d三点中水的电离程度最大的是_________。
、c、d三点中水的电离程度最大的是_________。
(3)若学习小组在该温度下用此醋酸滴定某未知浓度的KOH溶液:
①滴定过程中宜选用____________作指示剂;滴定达到终点的现象是_________________。
②下列操作会造成结果偏高的是_________。
A.酸式滴定管水洗后直接装入醋酸 B.锥形瓶水洗后未干燥
C.滴定终点时俯视酸式滴定管的读数D.部分酸滴到锥形瓶外面
③若滴定开始和结束时,酸式滴定管中的液面如图(2)所示,则所用醋酸的体积为_______mL。
(4)常温下,若向20 mL的稀氨水中逐滴加入等物质的量浓度的盐酸,下列变化趋势正确的是____(填序号)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com