
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:

已知:①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量FeO、MgO等。
②Li2O·Al2O3·4SiO2+H2SO4![]() Li2SO4+Al2O3·4SiO2·H2O
Li2SO4+Al2O3·4SiO2·H2O
③某些物质的溶解度(S)如下表所示。
T℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
④Fe3+完全沉淀时pH为3.4
(1)为提高原料浸出速率,除升高温度外还可采取的措施是__________(任写一条)。
(2)在滤液1中加入H2O2的目的是__________(用离子方程式表示);调节pH最佳试剂是__________(填序号 )。
A.CuO B.CuCO3 C.MgO D.NH3·H2O
(3)从滤渣中分离出Al2O3的流程如下图所示,请写出生成沉淀的离子方程式__________。
![]()
(4)向滤液2中加入Na2CO3溶液的作用是__________。
(5)“过滤、热水洗涤”步骤中,“热水洗涤”的原因是__________;证明沉淀已洗净的操作是__________。
【答案】适当增大硫酸浓度、减小原料颗粒直径、搅拌等(合理答案均可给分) 2Fe2++H2O2+2H+ =2Fe3++2H2O C Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 使Ca2+完全转化为沉淀(或除去Ca2+) 碳酸锂在热水中溶解度较小,热水洗涤可减少产品损失 取最后一次洗涤液,加入盐酸酸化,滴加Ba2+溶液,若无沉淀产生,说明已洗净
【解析】
锂辉石(Li2OAl2O34SiO2,含少量少量FeO、MgO等)经过加入硫酸酸化得到可溶性的硫酸锂、硫酸铝、硫酸亚铁、硫酸镁和不溶的二氧化硅,经过过滤,得到滤渣1二氧化硅,滤液1加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH=3.4,Fe3+完全沉淀,过滤得到滤渣2为氢氧化铁,滤液2加入石灰乳和碳酸钠溶液,以增加Ca2+、OH-的浓度,使Mg(OH)2、CaCO3更利于析出,过滤得到滤液Mg(OH)2和CaCO3,以便形成滤渣3,滤液中加入饱和碳酸钠溶液沉淀锂离子生成Li2CO3的沉淀,过滤热水洗涤Li2CO3的溶解度随温度升高而减小,可减少Li2CO3的损失,得到最终产物碳酸锂。
(1)为提高原料浸出速率,除升高温度外还可采取的措施是:适当增大硫酸浓度、减小原料颗粒直径、搅拌等,故答案为:适当增大硫酸浓度、减小原料颗粒直径、搅拌等;
(2)在滤液1中加入H2O2的目的是氧化亚铁离子调节溶液pH沉淀铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,调节pH最佳试剂是不能引入新的杂质,AB会引入铜离子,D会引入铵根离子,所以调节pH最佳试剂是C氧化镁,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;C;
(3)从滤渣中分离出Al2O3的流程如下所示,其中生成沉淀的反应是铝盐和过量氨水生成,反应的离子方程式Al3++3NH3H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
(4)向滤液2中加入Na2CO3溶液的作用是使Ca2+完全转化为沉淀(或除去Ca2+),故答案为:使Ca2+完全转化为沉淀(或除去Ca2+);
(5)图表数据可知碳酸锂溶解度随温度升高减小,“过滤、热水洗涤”步骤中,“热水洗涤”的原因是碳酸锂在热水中溶解度较小,热水洗涤可减少产品损失,证明沉淀已洗净的操作是:取最后一次洗涤液,加入盐酸酸化,滴加Ba2+溶液,若无沉淀产生,说明已洗净,故答案为:碳酸锂在热水中溶解度较小,热水洗涤可减少产品损失;取最后一次洗涤液,加入盐酸酸化,滴加Ba2+溶液,若无沉淀产生,说明已洗净。


科目:高中化学 来源: 题型:
【题目】镁的化合物在化工生产和药物合成上有重要用途。某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量Fe的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
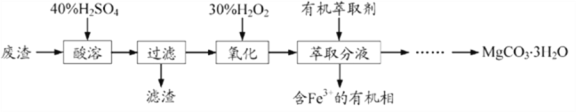
(1)滤渣的成分为________(填化学式),过滤装置在使用一段时间后需用NaOH溶液清洗,用化学方程式表示其清洗原理:____________________________。
(2)加入H2O2的目的是________________________,一段时间后,溶液中有气泡出现并放热,则产生气泡的原因是_______________________________。
(3)萃取分液中要用到分液漏斗,分液漏斗在使用前须洗干净并________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)

A. C1上发生还原反应
B. Cu电极与C2电极上的电极反应相同
C. M 装置中SO42-移向Cu电极
D. 工作一段时间后装置M 中溶液pH变小,装置N中溶液pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaHCO3溶液处理NaAlO2溶液(由Al2O3过量NaOH溶液反应制得),测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积的变化情况如图所示。下列说法正确的是( )

A. Al(OH)3的生成是因为NaHCO3促进了NaAlO2的水解
B. b点和c点溶液所含微粒种类不同
C. NaHCO3溶液的物质的量浓度为1.0mol·L-1
D. d点时:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应用电化学原理,回答下列问题:
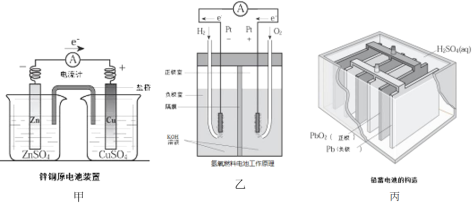
(1)上述三个装置中,负极反应物化学性质上的共同特点是_________。
(2)甲中电流计指针偏移时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是________。
(3)乙中正极反应式为________;若将H2换成CH4,则负极反应式为_______。
(4)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池______极相连接。
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按下图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:
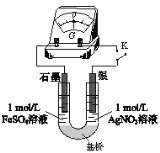
ⅰ.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
ⅱ.随后向U型管左侧逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
① 实验ⅰ中银作______极。
② 综合实验ⅰ、ⅱ的现象,得出Ag+和Fe2+反应的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH。
(1)利用如图所示的仪器可以组装实验装置,则仪器的连接顺序是____接D、E接_____、______接_____。

(2)有关反应的化学方程式为________________________________________________。
(3)有的同学认为此装置不能验证H2CO3和C6H5OH的酸性强弱,你认为________(填“有”或“没有”)道理。怎样改进实验才能验证H2CO3和C6H5OH的酸性强弱?
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷及其化合物在工农业生产中都有重要作用。
(1)基态磷原子价电子排布的轨道表示式为___________。
(2)元素B、N、O的第一电离能由大到小的顺序为___________。
(3)食品添加剂NaNO2中NO2-中心原子的杂化类型是_____,与NO2-互为等电子体的分子的化学式为___________。(写1种)。
(4)N2H4是火箭的燃料,与氧气的相对分子质量相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是____________。
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应合成。
①三溴化磷分子的空间构型是_________,三溴化硼键角是___________。
②磷化硼晶体晶胞如图所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为________,磷原子的配位数为___________,该结构中有一个配位键,提供空轨道的原子是___________。己知晶胞边长apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。

③磷化硼晶胞沿着体对角线方向的投影(图中虚线圆圈表示P原子的投影),用实线圆圈画出B原子的投影位置(注意原子体积的相对大小)。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)无水MgBr2可用作催化剂实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1。
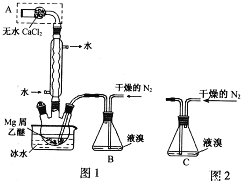
主要步骤如下:
步骤1 三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3反应完毕后恢复至室温,过滤除去镁,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。实验中不能用干燥空气代替干燥N2,原因是___________。
(2)如将装置B改为装置C(图2),可能会导致的后果是_______________________。
(3)有关步骤4的说法,正确的是___________。
A.可用95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴
(4)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4-=MgY2-
①滴定前润洗滴定管的操作方法是____________________________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是________________________(以质量分数表示)。
(II)化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)4=27H2O+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据__________________、_____________________;
(2)用离子方程式表示除去固体产物中Al2O3的原理________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com