
| A. | 乙烯的结构简式:CH2CH2 | |
| B. | 硫原子的结构示意图: | |
| C. | 基态188O的电子排布式:1s22s22p63s23p6 | |
| D. | 过氧化钠的电子式: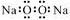 |
分析 A.烯烃结构简式要写出官能团;
B.硫原子核外有16个电子,3个电子层、最外层有6个电子;
C.基态188O的核外有8个电子,根据构造原理书写电子排布式;
D.过氧化钠是离子化合物,要标出阴阳离子所带电荷,并写出阴离子最外层电子数.
解答 解:A.烯烃结构简式要写出官能团,乙烯的结构简式为CH2=CH2,故A错误;
B.硫原子核外有16个电子,3个电子层、最外层有6个电子,原子结构示意图为 ,故B正确;
,故B正确;
C.基态188O的核外有8个电子,根据构造原理书写电子排布式为1s22s22p4,故C错误;
D.过氧化钠是离子化合物,要标出阴阳离子所带电荷,并写出阴离子最外层电子数,其电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题考查化学用语,涉及原子结构示意图、结构简式、原子核外电子排布式、电子式的书写,明确这些化学用语的书写规则是解本题关键,注意D中过氧化钠电子式的书写方式,为易错点.


科目:高中化学 来源: 题型:选择题
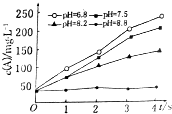 实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )
实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )| A. | 若增大压强,该反应的反应速率一定增大 | |
| B. | pH=6.8时,随着反应的进行反应速率逐渐增大 | |
| C. | 一定pH范围内,溶液中H+浓度越小反应速率越快 | |
| D. | 可采用调节pH的方法使反应停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4gNH3中含N-H键数目为0.2NA | |
| B. | 乙烯和环丙烷(C2H4)组成的28g混合气体中含有2NA个氢原子 | |
| C. | 15.6gNa2O2跟过量CO2反应时,转移电子数为0.2NA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;XOHCH2CH2OH;
;XOHCH2CH2OH; ;
; )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n +n
+n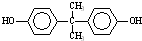 →
→ +4nCH3OH.
+4nCH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH2-CH3和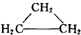 | B. | 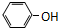 与 与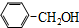 | ||
| C. | 分子组成都为 CnH2nO2 的物质 | D. | CH3CH2Cl与CH3CH2CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)═c(SO42-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COOH)═c(Cl-) | |
| C. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO3-)+2c(H2CO3)+2c(CO32-) | |
| D. | pH=1的NaHSO4溶液:c(H+)═2c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO4-发生了氧化反应 | |
| B. | 氧化剂与还原剂的物质的量之比为1:3 | |
| C. | 方程式“□”中的应填入OH- | |
| D. | 氧化产物与还原产物物质的量之比是5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氟是非金属性最强的元素:回答下列问题:
氟是非金属性最强的元素:回答下列问题: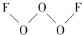 ,其中氧原子采用的轨道杂化方式是sp3,氟元素的化合价是-1.
,其中氧原子采用的轨道杂化方式是sp3,氟元素的化合价是-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2充足时,SO2可全部转化为SO3 | |
| B. | 加入催化剂是为了加快反应速率 | |
| C. | 达到化学平衡时SO2和SO3的浓度相等 | |
| D. | 达到化学反应限度时,反应停止进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com