
����Ŀ���������������գ���Ŀǰ����ˮ������������Ҫ����֮һ���乤���������£�
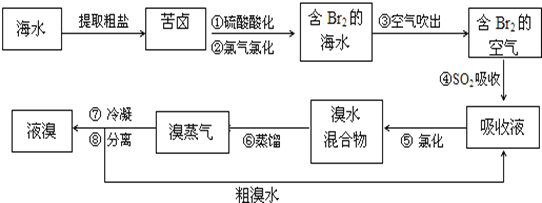
��1����������������ữ�����Cl2�������ʣ�������__________________________��
��2������ڷ�Ӧ�����ӷ���ʽΪ__________________________�������������SO2�Ļ�ԭ�ԣ���Ӧ�����ӷ���ʽΪ__________________________��
��3���������������У��¶�Ӧ������8090�档�¶ȹ�����Ͷ������������������ԭ��______________________��
��4���������������������õ�Һ������ˮ�Ļ������������ǵ�����ܶ����ܴ���ص���з��롣����������������__________________��
��5������١���֮��δֱ��������Br2�ĺ�ˮ����������õ�Һ�壬���Ǿ�������������������SO2�����������Ȼ���������������������������__________________________��
���𰸡��ữ���������������ˮ��Ӧ 2Br+Cl2=Br2+2Cl Br2+SO2+2H2O=4H++2Br-+SO42- �¶ȹ��ߣ�����ˮ������֮�ų���������ˮ�����ӣ��¶ȹ��ͣ��岻����ȫ���������ʵ� ��Һ©�� ������������SO2���ա��Ȼ����Ĺ���ʵ������һ��Br2��Ũ�����̣���ֱ������Br2��ˮ���Ч�ʸ��ߣ�������Դ�٣��ɱ�����
��������
���������������ڹ�ҵ��ģ��ˮ����ij��÷���������һ�ֹ�������Ԥ�Ⱦ����ữ��Ũ����ˮ�У��������û�������ʹ֮��Ϊ�����壬�̶�ͨ�������ˮ���������崵����������ʹ�����������ռ���������������ת�����������Դﵽ������Ŀ�ģ�Ȼ�������������������õ���Ʒ�塣
(1)��������ˮ��ˮ������Ӧ��������ʹ����ᣬ�ữ���������������ˮ��Ӧ��
(2)��������������������������嵥�ʣ�����ʽΪ2Br+Cl2=Br2+2Cl����������嵥�ʽ�����������ˮ��Һ�����������ᣬ���ӷ���ʽΪBr2+SO2+2H2O=4H++2Br-+SO42-��
(3)����ˮ�У��¶ȹ��ߣ�����ˮ������֮�ų���������ˮ�����ӣ��¶ȹ��ͣ��岻����ȫ���������ʵͣ�
(4)��Һ������ˮ�����ܣ����÷�Һ©�����룻
(5)��ˮ�������ӵĺ������٣��ں�ˮ��ȡ��֮ǰ��������к�ˮŨ����������������SO2���ա��Ȼ����Ĺ���ʵ������һ��Br2��Ũ�����̣���ֱ������Br2��ˮ���Ч�ʸ��ߣ�������Դ�٣��ɱ����͡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪N2(g)+3H2(g)![]() 2NH3(g)��H<0�����ϳɰ������˷�Ӧ�Ĺ���������Ϊ���ٷ�Ӧ�¶ȣ�300�棻�ڷ�Ӧѹǿ��300 atm����ʹ���������������в��Ǵ����������NH3ƽ��Ũ�������ǵ��ǣ� ��
2NH3(g)��H<0�����ϳɰ������˷�Ӧ�Ĺ���������Ϊ���ٷ�Ӧ�¶ȣ�300�棻�ڷ�Ӧѹǿ��300 atm����ʹ���������������в��Ǵ����������NH3ƽ��Ũ�������ǵ��ǣ� ��
A.�٢�B.�٢�C.�ڢ�D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ����Ϊ̽������Ũ����![]() ����
����![]() �ķ�Ӧ������֤
�ķ�Ӧ������֤![]() �����ʣ������ͼ��ʾװ�ý���ʵ�飬����˵������ȷ���ǣ���
�����ʣ������ͼ��ʾװ�ý���ʵ�飬����˵������ȷ���ǣ���
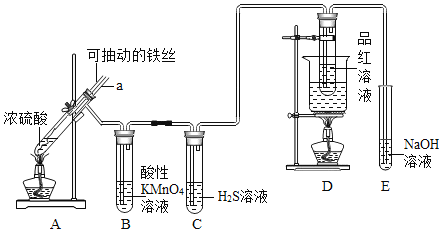
A.װ��B������![]() ��Һ����ɫ�������˶�������Ļ�ԭ��
��Һ����ɫ�������˶�������Ļ�ԭ��
B.ʵ����������װ��A����Һ�еμ�KSCN��Һ�Լ������ɵ�![]()
C.װ��D��Ʒ����Һ��ɫ������֤![]() ��Ư����
��Ư����
D.ʵ��ʱ������a����Ũ�����У��ɷ�ֹװ��B�е���Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������˵��2HI��g��H2��g��+I2��g���Ѵ�ƽ��״̬����__________
�ٵ�λʱ��������nmolH2��ͬʱ������nmolHI��
��1��H��H�����ѵ�ͬʱ��2��H��I�����ѣ�
�ۻ�����аٷ����ΪHI%=I2%��
�ܷ�Ӧ����v��H2��=v��I2��=![]() v��HI��ʱ��
v��HI��ʱ��
�ݻ��������c��HI����c��H2����c��I2��=2��1��1ʱ��
���¶Ⱥ����һ��ʱ��ijһ������Ũ�Ȳ��ٱ仯��
���¶Ⱥ����һ��ʱ��������ѹǿ���ٱ仯��
������һ������������ƽ�������������ٱ仯��
���¶Ⱥ����һ��ʱ������������ɫ���ٱ仯��
���¶Ⱥ�ѹǿһ��ʱ�����������ܶȲ��ٱ仯��
�����ޡ����˵������˵��2NO2N2O4�ﵽƽ��״̬����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ�FeSO4��Һ��ƣ�һ����Ϊ�DZ�����Ϊ��Ե�ʡ��ش��������⣺
(1)���õ�FeSO4��Һ��Fe3+�ļ��飺
����õ�FeSO4��Һ�м���KSCN������Ϊ��______________________________������Fe3+���õ�FeSO4��Һ�м�������KI��������Һ��������Һ��������Ӧ�����ӷ���ʽ��________________________________________��
(2)��ȥ����FeSO4��Һ��Fe3+��
����Һ�м����������ۣ����Թ۲쵽������Ϊ______________________����Ӧ�����ӷ���ʽΪ��_____________________________��������ͭ����Ϊ��ȥFeSO4��Һ��Fe3+�Լ���ԭ��__________________________��
(3)�������ϣ���Һ��Fe2+���������̷�Ϊ������������Fe2+ˮ��ΪFe(OH)2������ˮ����ﱻO2������
д��Fe(OH)2�ڿ����б������Ļ�ѧ����ʽ��________________________________��������Ϊ��__________________________________________________
(4)ij�о�С���о������²�ͬpH��Fe2+��O2������Ӱ�죬��ͼ�����ͼ������ͬpH��Fe2+��O2�����ķ�Ӧ������������Ӱ�죺___________________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ������������⡣
(1)��ϵͳ�������������л���������
��![]() _________________����
_________________���� _______________��
_______________��
(2)д�������л���Ľṹ��ʽ��
�ٱ�_____________���ڱ�����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ�õ�������ҩƷ�ܴﵽʵ��Ŀ�ĵ���
A | B | C | D |
|
|
|
|
��ȡNaHCO3 | ���鷴Ӧ������SO2 | ����ʱ�Ľ���װ�� | ��ȡNO |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�������ʵ�����mgͭ���Ͻ���Ʒ��ͭ������������

����˵������ȷ����![]()
A.�ռ�����VL���嶼��NO
B.�����õ��IJ��������ǣ��ձ���©����������
C.������Ӧ��ϴ��
D.����������֪������������Ͻ���ͭ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(10��)����ͼ��ʾװ�ÿ�������ȡ�۲�Fe(OH)2�ڿ����б�����ʱ��ɫ�ı仯��ʵ��ʱ����ʹ����м��6 mol/L�����ᣬ�����Լ���ѡ����д���пհס�

��1��B��ʢһ������NaOH��Һ��A��ӦԤ�ȼ�����Լ���____________��A�з�Ӧ�����ӷ���ʽ�ǣ�_________��
��2��ʵ�鿪ʼʱ���Ƚ�����E______(�������������ر���)��C���ռ����������Ҫ�ɷ���________��
��3����������Fe(OH)2�IJ�������________________��
��4����ȥװ��B�е���Ƥ����ʹ�������룬д���йط�Ӧ�Ļ�ѧ����ʽ��__________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com