
【题目】Ⅰ.次磷酸(H3PO2) 是一种精细磷化工产品,具有较强还原性:
(1)H3PO2是一元中强酸,写出其电离方程式_____________。
(2)H3PO2 及NaH2PO2 均可将溶液中的Ag+还原为银,从而可用于化学镀银。利用H3PO2 进行化学镀银反应中,当氧化产物为H3PO4 时,氧化剂与还原剂的物质的量之比为_____.
Ⅱ.工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质),制取七水合硫酸亚铁(FeSO4·7H2O),流程如图:

(3)还原时,试剂X 若选用SO2,则反应后的阴离子是__________(填化学式)。
(4)从分离出滤渣Ⅱ后的滤液中得到产品,应进行的操作是_____、______、过滤、洗涤、干燥。
(5)七水合硫酸亚铁(FeSO4·7H2O) 在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a: 取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL 溶液;
步骤b: 取上述溶液25mL 于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.010mol/L 的KMnO4
溶液,至恰好完全反应,记录消耗的KMnO4 溶液的体积(假定药品中其他成分不与KMnO4 反应),发生的反应为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
步骤c: 重复“步骤b”2~3 次,平均消耗KMnO4 溶液20.00mL。
①步骤a 中配制溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需要____、____。
②该补血剂中亚铁离子的含量为__________mg/片。
【答案】 H3PO2![]() H++H2PO2- 4:1 SO42- 蒸发浓缩 冷却结晶 玻璃棒 250 mL 容量瓶 56
H++H2PO2- 4:1 SO42- 蒸发浓缩 冷却结晶 玻璃棒 250 mL 容量瓶 56
【解析】(1)H3PO2是一元中强酸,为弱酸,部分电离出氢离子,其电离方程式:H3PO2![]() H++H2PO2- ;正确答案:H3PO2
H++H2PO2- ;正确答案:H3PO2![]() H++H2PO2- 。
H++H2PO2- 。
(2)Ag+为氧化剂,为xmol, H3PO2为还原剂,为ymol, 根据电子守恒可知:x×1=y×(5-1),所以x:y=4:1;正确答案:4:1。
(3)试剂X若选用![]() ,发生反应:
,发生反应:![]() ,则阴离子为
,则阴离子为![]() ;正确答案:SO42- 。
;正确答案:SO42- 。
(4)滤渣Ⅱ为氢氧化铝,即![]() ,滤液中含有硫酸亚铁,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可得到
,滤液中含有硫酸亚铁,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可得到![]()
![]() ;正确答案:蒸发浓缩 ;冷却结晶。
;正确答案:蒸发浓缩 ;冷却结晶。
5)①配制![]() 溶液需要的玻璃仪器除有烧杯、胶头滴管、玻璃棒、250mL容量瓶;正确答案:玻璃棒 ;250mL容量瓶。
溶液需要的玻璃仪器除有烧杯、胶头滴管、玻璃棒、250mL容量瓶;正确答案:玻璃棒 ;250mL容量瓶。
②根据反应关系可知:MnO4----5Fe2+,消耗n(MnO4-)=0.01×20×10-3=2×10-4mol,25 mL溶液中n(Fe2+)=5×2×10-4=10-3mol, 250mL溶液中n(Fe2+)=10-3×10=10-2mol,10片补血剂中含有n(Fe2+)=10-2mol, 1片补血剂样品中n(Fe2+)=10-3mol, m(Fe2+)=10-3×56=0.056g=56mg;正确答案:56。


科目:高中化学 来源: 题型:
【题目】某学生欲用12molL﹣1浓盐酸和蒸馏水配制480mL物质的量浓度为0.30molL﹣1的稀盐酸.
(1)该学生需要量取________mL上述浓盐酸进行配制.
(2)配制过程中正确的操作顺序是(字母表示,每个字母只能用一次)________;
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”、“无影响”).
A.用量筒量取浓盐酸时俯视观察凹液面________
B.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水________
C.稀释浓盐酸时,未冷却到室温即转移到容量瓶中________
D.将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中________
E.容量瓶洗涤干净后未干燥________
(4)若在标准状况下,将V LHCl气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,则此溶液中HCl物质的量浓度为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,5.6LCl2与足量NaOH反应转移的电子数为0.25NA
B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO32HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃。
(1)锌离子的电子排布式是_____________。
(2)根据元素周期律,电负性S______Se,第一电离能Se________As(填“>”或“<”)。
(3)H2O的沸点______________(填“>”或“<”)H2Se的沸点,其原因是:______。
(4)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于______。若已知铜的原子半径为d厘米,表示原子空间占有率的代数式为_____________

(5)A是短周期中原子半径最大的元素; C是A所在周期电负性最大的元素;A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图。
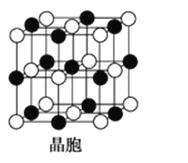
晶胞中距离一个A+最近的C-围成的图形是______________(写名称),若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,晶体中距离最近的两个A+之间的距离为________cm(用含NA与ρ的式子表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知空气-锌电池的电极反应为锌片:Zn+2OH--2e-=ZnO+H2O,石墨:O2+2H2O+4e-=4OH-据此判断锌片是( )
A.负极,发生氧化反应B.负极,发生还原反应
C.正极,发生氧化反应D.正极,发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)简述氢氧化铁胶体的制备方法______________________________ 。
(2)用Na2CO3·10H2O晶体配制0.10 mol/L Na2CO3溶液480 mL。
①实验时要用到的仪器有:除托盘天平、量筒、烧杯、玻璃棒、胶头滴管外,至少还必须用到的一种玻璃仪器是___________________,在使用该仪器前必须进行 的操作是_____________,在萃取实验中也需要该操作的仪器是_____________;
②用托盘天平称取Na2CO3·10H2O晶体的质量为___________g;
③配制溶液时有以下几个操作:
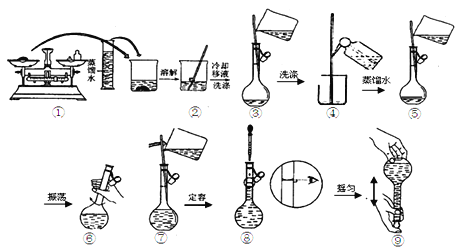
配制过程中,下列操作对所配溶液的浓度有什么影响,完成填空。
a.Na2CO3·10H2O晶体不纯,混有NaCl
b.用“左码右物”的称量方法称量晶体
c.容量瓶中洗净后未干燥,残留少量水
d.未冷却至室温就转移定容
e.加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出
f.定容时,俯视刻度线
会引起所配溶液的浓度偏大的有________,无影响的有________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为Y2X3(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
A. 原子半径:Y>Z>R>T B. 气态氢化物的稳定性:W<R<T
C. 最高价氧化物对应的水化物的碱性:X>Z D. XR2、WR2两种化合物中R的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)直接热分解法制氢。某温度下,H2O(g)![]() H2(g)+
H2(g)+![]() O2(g)。该反应的平衡常数表达式为K=_____。
O2(g)。该反应的平衡常数表达式为K=_____。
(2)乙醇水蒸气重整制氢。其部分反应过程和反应的平衡常数随温度变化曲线如图1所示:

反应中,某温度下每生成1mol H2(g) 热量变化是62 kJ。则该温度下图1所示反应的热化学方程式是______________________________________。
(3)水煤气法制氢。CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH <0,在进气比[n(CO)∶n(H2O)]不同时,测得相应的CO的平衡转化率见图2(各点对应的反应温度可能相同,也可能不同)。
CO2(g)+H2(g) ΔH <0,在进气比[n(CO)∶n(H2O)]不同时,测得相应的CO的平衡转化率见图2(各点对应的反应温度可能相同,也可能不同)。

①往维持恒温的2L密闭容器中加入一定量的CO和0.lmol H2O(g),在图中G点对应温度下反应经5min 达到平衡,则v(CO) 等于_________mol/(L·min)
②图中B、E 两点对应的反应温度分别为TB和TE判断:TB______TE (填“<”“=”或“>”)。
③经分析,A、E 和G三点对应的反应温度都相同为T℃,其原因是A、E 和G三点对应的_____________相同。
④当T℃时,若向一容积可变的密闭容器中同时充入3.0 mol CO、1.0 mol H2O、1.0mol CO2和x mol H2,要使上述反应开始时向正反应方向进行,则x应满足的条件是_________________________________。
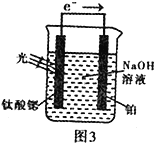
(4)光电化学分解制氢。其原理如图3,钛酸锶光电极的电极反应为:4OH--4e-![]() O2+2H2O
O2+2H2O
则铂电极的电极反应为_______________________________。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成Mg2Cu和仅含一种金属元素的氢化物(其中氢的质量分数约为0.077)。Mg2Cu与H2反应的化学方程式为___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com