
【题目】A、B、C、D、E是原子序数依次增大的前四周期的常见元素。己知:
A | 原子半径最小 |
B | 核外3个能级上的电子数相等 |
C | 其氢化物的沸点比同族相邻周期元素氢化物的沸点高 |
D | 2p轨道上成对电子数与未成对电子数相等 |
E | N 层电子数为1,内层轨道全部排满电子 |
(1)写出E原子基态核外电子排布式_____________。比较B、C、D电负性的大小顺序______ (按由小到大) 。
(2)与C2互为等电子体的分子有_______,离子有_________。
(3)E2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物(如图),画出其中E2+离子与N、O原子间的化学键。________。

(4)E和金(Au)形成的合金的晶胞结构如图,则该合金的化学式可表示为________________。

【答案】 1s22s22p63s23p63dl04s1 或[Ar] 3d104s1 C N O CO CN-或C22- 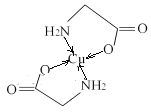 Cu3Au
Cu3Au
【解析】试题分析:由题意知,A原子半径最小,则A为H;B核外3个能级上的电子数相等,其电子排布式为1s22s22p2,则B为C;D的2p轨道上成对电子数与未成对电子数相等,其电子排布式为1s22s22p4,则D为O;C的氢化物的沸点比同族相邻周期元素氢化物的沸点高,则C为N,其氢化物可以形成分子间氢键,故沸点较高;E的N层电子数为1,内层轨道全部排满电子,则其价电子排布式为3d104s1,E为Cu。所以A、B、C、D、E分别为H、C、N、O、Cu等元素。
(1)Cu原子基态核外电子排布式为1s22s22p63s23p63dl04s1或[Ar]3d104s1。比较C、N、O电负性由小到大的顺序为C N O 。
(2)与N2互为等电子体的分子有CO,离子有CN-或C22-。
(3)Cu2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物,其中Cu2+离子与N、O原子间的化学键可表示为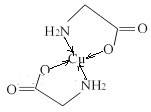 。
。
(4)由Cu和金(Au)形成的合金的晶胞结构示意图可知,该晶胞中有1个Au原子(8个顶点,8![]() )、3个Cu原子(6个面心,6
)、3个Cu原子(6个面心,6![]() ),则该合金的化学式可表示为Cu3Au.
),则该合金的化学式可表示为Cu3Au.


科目:高中化学 来源: 题型:
【题目】室温下,下列叙述正确的是
A. 若V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合后显中性,则V1≤V2
B. 等体积、等物质的量浓度的NaCl溶液中离子总数大于NaClO溶液中离子总数
C. 等体积、等物质的量浓度的Na2CO3和NaHCO3溶液混合:![]() <
<![]()
D. 将CH3COOH溶液与NaOH溶液混合,若混合后的溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+),且溶液显酸性,则c(OH-)+c(CH3COO-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,某科研小组采用如下方案由铬铁矿(主要成分为FeO·Cr2O3,还含有SiO2、Al2O3 等杂质)制备重铬酸钾。
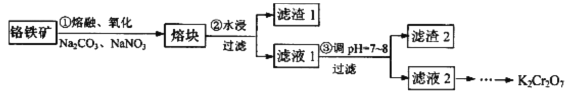
己知:①铬铁矿在熔融、氧化过程中发生的主要反应:
FeO·Cr2O3+Na2CO3+ NaNO3![]() Na2CrO4+ Fe2O3+ CO2↑+NaNO2
Na2CrO4+ Fe2O3+ CO2↑+NaNO2
Na2CO3+Al2O3![]() NaA1O2+CO2↑
NaA1O2+CO2↑
②2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
③有关物质的溶解度如图所示。

(1)步骤①中反应物NaNO3的作用是_______,熔融时所用的仪器为________(填字母)。
A瓷坩埚 B.铁坩埚 C.氧化铝坩埚
(2)步骤②所得的滤渣1中含量最多的金属元素是___________。
(3)步骤③可用醋酸调节滤液1的pH至7~8,可用__________(填仪器或用品名称)测定溶液的pH,写出步骤③加醋酸生成Al(OH)3 的离子方程式____________________________________。
(4)请设计从滤液2(主要溶质为Na2CrO4)制取K2Cr2O7固体的实验方案:__________(实验中须使用的试剂有: KC1固体、1mol/L硫酸溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修5:有机化学基础】化合物Ⅰ是有机合成中的一种重要中间体,具体合成过程如下(部分产物及条件略去):

①
②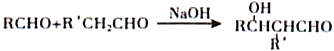
③![]()
④化合物A的一氯代物只有一种
(1)I分子中含有的官能团名称为________________________________。
(2)A→B的反应类型为__________________,G→H的反应类型为____________。
(3)D的化学名称为___________________________。
(4)C的结构简式为_________________,L的结构简式为_______________。
(5)G→J中过程①的化学方程式为_________________________,J→K的化学方程式为___________________________。
(6)同时满足下列条件的I的同分异构体有_________种(不考虑立体异构,不包括I)。
①与具有相同的官能团 ②具有六元碳环结构 ③分子中有一个甲基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体A在一定条件下可完全分解,生成B、C、D三种气体的混合物。反应方程式如下:2A=B↑+2C↑+3D↑,此时测得混合气体的相对平均分子质量为26,则固体A的摩尔质量为( )
A. 30g/mol B. 90g/mol C. 78g/mol D. 90
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中含有的少量杂质(括号中的物质)的方法,错误的是( )
A.NH4Cl溶液(I2)用CCl4萃取
B.NO(NH3)通过水洗涤
C.NaCl(NH4Cl)加热固体混合物
D.N2(NO2)通过水洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是生物体内四种有机物的组成与功能关系图,请据图回答下列问题:

(1)物质F的元素组成是____________。
(2)生物体内C的种类有__________种,其种类不同是由____________决定。现有一抗体G,它由4条肽链构成,共有764个氨基酸,则该抗体分子中至少含有游离的氨基______个。
(3)小麦种子细胞中,物质E主要是指________。相同质量的E和F彻底氧化分解,耗氧量较多的是________(填字母)。
(4)组成SARS病毒的小分子D是__________,是由____________、______________和____________构成的。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com