
| A. | 将0.2 mol/L的NH4Al(SO4)2溶液与0.3 mol/L的Ba(OH)2溶液等体积混合:2NH4++Al3++3SO42-+3Ba2++6OH-═Al(OH)3↓+AlO2-+3BaSO4↓+2H2O | |
| B. | 将含有等物质的量溶质的NaHCO3溶液和Ba(OH)2溶液混合:Ba2++HCO${\;}_{3}^{-}$+OH-═BaCO3↓+H2O | |
| C. | 在重铬酸钾溶液中,加酸后溶液变为黄色:Cr2O72-+H2O═2 CrO42-+2H+ | |
| D. | 过量氯水与FeI2溶液作用:2Fe2++2I-+2Cl2═2 Fe3++I2+4Cl- |
分析 A.物质的量比为2:3,反应生成硫酸钡、氢氧化铝、硫酸铵;
B.等物质的量反应生成碳酸钡、水、NaOH;
C.Cr2O72-(橙红色)+H2O?2H++2CrO42-(黄色),为可逆反应;
D.碘离子、亚铁离子均为氧化.
解答 解:A.将0.2 mol/L的NH4Al(SO4)2溶液与0.3 mol/L的Ba(OH)2溶液等体积混合的离子反应为2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,故A错误;
B.含有等物质的量溶质的NaHCO3溶液和Ba(OH)2溶液混合的离子反应为Ba2++HCO3-+OH-═BaCO3↓+H2O,故B正确;
C.在重铬酸钾溶液中,加酸后Cr2O72-(橙红色)+H2O?2H++2CrO42-(黄色)逆向进行,溶液变为橙红色,故C错误;
D.过量氯水与FeI2溶液作用的离子反应为2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl-,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,注重离子反应的综合训练,题目难度不大.


科目:高中化学 来源: 题型:推断题
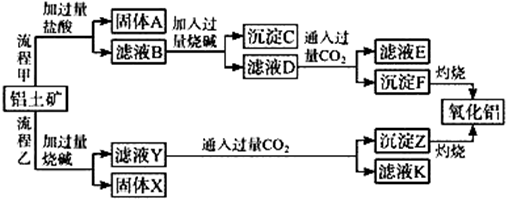
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
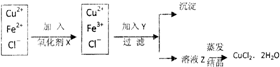
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
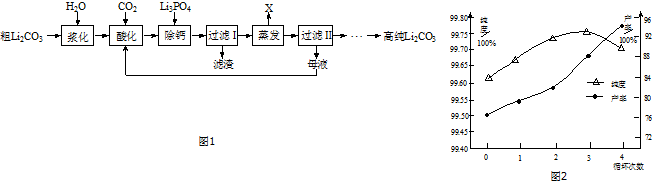
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80% | B. | 60% | C. | 40% | D. | 33.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17.2 | B. | 1.72 | C. | 1.2 | D. | 0.0172 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com